GHS-R1a对高脂饮食小鼠糖代谢及腹部脂肪影响
时间:2023-01-20 19:50:07 来源:柠檬阅读网 本文已影响 人 
怀宙阳,董冰子,邓玉杰,尹艺蓉,信芳杰,李成乾
(1 青岛大学附属烟台毓璜顶医院保健科,山东 烟台 264000;
2 青岛大学附属医院内分泌科;
3 青岛大学附属医院病理科)
Ghrelin是一种包含28个氨基酸的脑肠肽,主要由胃底X/A样细胞分泌产生,是生长激素促分泌素受体(GHS-R)的内源性配体[1-2]。GHS-R包括GHS-R1a和GHS-R1b两种亚型。其中GHS-R1a活性较高,是Ghrelin最主要的内源性受体,也是发挥生物学效应最主要的亚型[3]。GHS-R1a主要表达于胰岛β细胞、垂体促生长激素细胞、下丘脑、海马、腹侧被盖区、黑质和中缝背核[4-7]。Ghrelin的主要功能是促进生长激素释放、食物摄取和脂肪沉积[8-10]。除此之外,Ghrelin还可以通过抑制胰岛素分泌和调节糖异生/糖原分解来调节葡萄糖稳态。Ghrelin信号通路已越来越被认为在肥胖、胰岛素抵抗和糖尿病中起到关键调节作用,而且多项研究表明其调节作用似乎独立于Ghrelin对食物摄入的影响[11-12]。目前关于Ghrelin及其受体在肥胖及糖代谢中的作用并未被完全阐明,有研究表明Ghrelin可增加胰岛β细胞数量并促进胰岛素的分泌[13-14],亦有研究表明Ghrelin可抑制葡萄糖刺激下的胰岛素分泌[15-17]。Ghrelin及其受体在糖代谢中的作用尚存在争议。本研究旨在通过制备GHS-R1a基因敲除(KO)小鼠模型,探讨GHS-R1a对高脂饮食小鼠体质量、腹部脂肪及糖代谢的影响。
1.1 实验动物及分组
雌性野生型(WT)C57BL/6小鼠购自维通利华实验动物技术有限公司(中国北京)。从上海南方模式生物研究中心获得C57BL/6背景下的GHS-R1aKO小鼠(GHSR-/-,GHS-R1a外显子1和2缺失),在扩大群体前与C57BL/6小鼠回交7代以上[18-19]。小鼠饲养条件:环境温度25 ℃,12 h昼夜循环光照(7:00-19:00进行光照),湿度50%~60%,自由运动、饮水及进食。选取6周龄WT雌性C57BL/6小鼠10只,随机分为普通饮食(脂肪质量分数为0.10)组(WT RD组,n=5)和高脂饮食(脂肪质量分数为0.60)组(WT HFD组,n=5);
选取6周龄GHS-R1aKO雌性C57BL/6小鼠10只,随机分为普通饮食组(KO RD组,n=6)和高脂饮食组(KO HFD组,n=4)。小鼠的处理规程经青岛大学动物保护与使用委员会认证,本研究符合《实验室护理及使用指南》的指导方针。
1.2 观察指标及测定方法
从6周龄到15周龄,每周在同一时间(上午9:00-10:00)测量体质量。于16周龄时行腹腔葡萄糖耐量试验(IPGTT):22:00至次日6:00禁食,收集各组小鼠的尾静脉血,应用美国强生公司生产的稳步血糖仪测定空腹血糖(即0 min血糖),按照1.5 mg/kg剂量给予葡萄糖腹腔注射,测定注射后15、30、60、120 min血糖。17周龄时,将小鼠安乐死后取出肝脏及腹内白色脂肪组织,同时取血分离血清。取出的腹内脂肪称质量后在室温下置于40 g/L多聚甲醛溶液中固定过夜,然后脱水并包埋在石蜡中,石蜡切片行苏木精-伊红(HE)染色。每只小鼠腹内脂肪石蜡切片在20倍光学显微镜下随机选取10个不同视野,应用Image J软件根据脂肪细胞轮廓范围计算每个脂肪细胞面积,最后取平均值得到单个脂肪细胞面积。计算腹内脂肪比例:腹内脂肪比例=腹内脂肪质量(g)/体质量(g)。并采用酶联免疫吸附测定(ELISA)方法检测各组小鼠血清胰岛素水平。
1.3 统计学方法
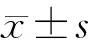
2.1 高脂饮食对KO小鼠体质量的影响
基因型、饮食方式、周龄对小鼠6~15周龄体质量的影响不存在交互作用(F=0.62~2.03,P>0.05)。单独效应分析显示,相同周龄时4组小鼠体质量比较差异均无显著性(P>0.05)。见图1。

图1 不同周龄时各组小鼠体质量比较
基因型和饮食方式对15周龄较6周龄小鼠体质量变化量的影响不存在交互作用(F=0.24,P>0.05)。单独效应分析显示,WT HFD组的体质量变化量明显高于WT RD组(F=6.99,P<0.05),而KO HFD组与KO RD组比较差异无统计学意义(P>0.05)。见表1。
2.2 高脂饮食对KO小鼠脂肪组织的影响
基因型和饮食方式对小鼠腹内脂肪质量、腹内脂肪比例的影响存在交互作用(F=5.85、6.55,P<0.05),对肝脏质量的影响也不存在交互作用(F=2.54,P>0.05)。单独效应分析显示,WT HFD组小鼠腹内脂肪质量、腹内脂肪比例均显著大于KO HFD组(F=4.79、6.39,P<0.05),而WT RD组与KO RD组比较差异均无显著性(P>0.05)。4组小鼠肝脏质量比较差异无显著性(P>0.05)。见表1。
基因型和饮食方式对脂肪细胞面积的影响不存在交互作用(F=4.04,P>0.05)。单独效应分析显示,KO HFD组小鼠脂肪细胞面积较WT HFD组小(F=12.30,P<0.01),而WT RD组和KO RD组比较差异无显著性(P>0.05)。见表1和图2。

表1 各组小鼠体质量变化量及腹内脂肪指标的比较

A:WT RD组;
B:KO RD组;
C:WT HFD组;
D:KO HFD组。HE染色,20倍。
2.3 高脂饮食对KO小鼠糖代谢的影响
基因型和饮食方式对IPGTT血糖的影响不存在交互作用(F=1.09,P>0.05)。单独效应分析显示,WT HFD组小鼠的空腹血糖水平显著高于KO HFD组(P<0.01),而WT RD组和KO RD组比较差异无显著性(P>0.05);
WT HFD组小鼠注射后15 min血糖显著高于WT RD组和KO RD组(P<0.05);
4组小鼠注射后30 min血糖水平比较差异无显著性(P>0.05);
WT HFD组小鼠注射后60 min血糖水平显著高于KO RD组(P<0.05);
4组小鼠注射后120 min血糖水平差异无统计学意义(P>0.05)。见图3。

WT RD组与WT HFD组比较,*P<0.05;
KO RD组与WT HFD组比较,#P<0.05;
KO HFD组与WT HFD组比较,&P<0.05。
基因型和饮食方式对小鼠IPGTT曲线下面积(AUC)的影响不存在交互作用(F=2.18,P>0.05)。单独效应分析结果显示,WT HFD组明显高于KO HFD组(F=6.40,P<0.05),而WT RD组与KO RD组差异无显著性(P>0.05);
WT HFD组明显高于WT RD组(F=7.80,P<0.05),而KO HFD组与KO RD组差异无显著意义(P>0.05)。见表2。

表2 各组小鼠IPGTT-AUC、空腹胰岛素水平比较
基因型和饮食方式对空腹胰岛素水平的影响存在交互作用(F=19.98,P<0.01)。单独效应分析显示,WT HFD组小鼠空腹胰岛素水平显著高于KO HFD组(F=26.88,P<0.01),而WT RD组和KO RD组比较差异无显著性(P>0.05);
WT HFD组空腹胰岛素水平显著高于WT RD组(F=25.30,P<0.01),而KO HFD组和KO RD组比较差异无显著性(P>0.05)。见表2。
Ghrelin和其主要受体GHS-R1a通过作用于胰岛以及胰岛素作用的外周组织和大脑参与糖代谢[20],但其机制尚未完全阐明。SUN等[21]在ob/ob小鼠模型中发现,敲除Ghrelin组小鼠血糖较对照组降低,葡萄糖诱导的胰岛素分泌增多,同时外周组织的胰岛素敏感性提高。但MA等[22]在ob/ob小鼠中发现,与对照组相比,GHS-R敲除组小鼠胰岛素水平更低,血糖更高,糖耐量异常的程度更重。与上述研究不同,本研究的雌性肥胖小鼠模型是由高脂饮食诱导的。本研究结果显示,在高脂饮食下,KO小鼠的空腹血糖和空腹胰岛素水平均显著低于WT小鼠,且IPGTT-AUC显著低于WT小鼠;
在普通饮食下,WT小鼠和KO小鼠的上述指标未见明显差异。提示GHS-R1a敲除可以抵抗高脂负荷引起的血糖升高,并增强胰岛素敏感性。而ZIGMAN等[23]的研究并未在高脂饮食和雌性小鼠中比较血糖和胰岛素水平,其结果仅显示,普通饮食下雄性GHS-R敲除小鼠血糖和空腹胰岛素水平较WT小鼠降低。
葡萄糖代谢产生的活性氧(ROS)可诱发胰岛素分泌,而线粒体解偶联蛋白2(UCP2)是β细胞ROS的负调控因子,Ghrelin的缺失降低了胰腺中UCP2 mRNA的表达,增强了葡萄糖诱导的胰岛素分泌[24-26]。已有研究结果表明,Ghrelin通过调节胰腺UCP2表达和胰岛素敏感性维持葡萄糖稳态[21]。MA等[22]在GHS-R敲除的ob/ob小鼠模型发现,GHS-R敲除损害了胰岛细胞功能,而GHS-R的缺失上调了胰腺中阴性的细胞调节因子(如UCP-2、SREBP-1c、ChREBP和MIF-1),下调了阳性的细胞调节因子(如HIF-1、FGF-21和PDX-1)。本研究结果提示,GHS-R敲除对肥胖导致的血糖升高有保护作用,并可以增加胰岛素敏感性,其具体机制还有待进一步研究。
本研究结果显示,高脂饮食喂养WT小鼠的15周龄较6周龄体质量变化量显著高于普通饮食WT小鼠,而高脂饮食喂养KO小鼠体质量变化量与普通饮食KO小鼠比较差异无显著性,提示GHS-R敲除可能可以改善高脂饮食引起的肥胖。在本研究中,普通饮食下KO小鼠和WT小鼠的腹内脂肪质量、腹内脂肪比例均未见明显差异,而高脂饮食下WT小鼠腹内脂肪质量、腹内脂肪比例均显著大于KO小鼠,提示GHS-R1a敲除可以抵抗高脂饮食负荷引起的脂肪增加。脂肪组织表达丰富的GHS-R1a,有研究表明,GHS-R敲除减少了白色脂肪组织中的葡萄糖和脂质摄取,抑制了脂肪的生成,可改善肥胖[27-29]。但MA等[22]研究结果显示,GHS-R敲除ob/ob小鼠与GHS-R未被敲除ob/ob小鼠相比,体质量及体脂含量差异并无显著性,提示瘦素对体质量及脂肪的影响可能大于Ghrelin通过GHS-R介导的对体质量及脂肪的影响。今后课题组将进一步探索在高脂饮食诱导的肥胖小鼠和ob/ob小鼠中Ghrelin对糖脂代谢的作用。RASINENI等[30]研究发现,乙醇诱导的血清Ghrelin水平升高,可以促进脂肪释放游离脂肪酸,抑制脂联素并促进白细胞介素-6、趋化因子配体2等细胞因子的分泌,导致肝脏脂肪变性。本研究没有显示KO小鼠和WT小鼠在肝脏脂肪沉积程度上有差异。这可能与本研究小鼠数量较少有关,今后我们将增加小鼠数量,进一步探讨在GHS-R1a敲除小鼠模型中高脂饮食对肝脏脂肪沉积的影响。
综上所述,小鼠GHS-R1a敲除可以抵抗高脂饮食诱导的肥胖和腹部脂肪堆积,改善胰岛素敏感性和糖耐量异常,这为针对Ghrelin/GHS-R1a通路治疗肥胖和糖耐量异常提供了一定的理论依据。
猜你喜欢 高脂周龄显著性 一种结合多尺度特征融合与像素损失加权的显著性目标检测方法黑龙江大学自然科学学报(2022年1期)2022-03-29白羽绿头鸭生长与产肉性能研究特产研究(2022年1期)2022-02-22申鸿七彩雉血液生化指标和肌内脂肪含量的测定及其相关性分析特产研究(2021年6期)2021-12-08申鸿七彩雉血液生化指标的正常参考值研究畜禽业(2021年11期)2021-11-22吃高脂鱼类可防癌家庭科学·新健康(2019年7期)2019-08-21基于区域特征聚类的RGBD显著性物体检测小型微型计算机系统(2019年4期)2019-05-05基于显著性权重融合的图像拼接算法电子制作(2019年24期)2019-02-23欧盟法院判决明确欧盟商标通过使用获得显著性的地域认定标准中国知识产权(2018年12期)2018-12-29鱼油可减轻高脂饮食的危害中国新闻周刊(2016年33期)2016-10-27褐壳蛋鸡农村百事通(2016年6期)2016-05-14








