绿萼凤仙花MYB4的克隆及表达分析
时间:2023-04-14 11:55:04 来源:柠檬阅读网 本文已影响 人 
李泽凤向南星魏春梅李新艺孟丹晨黄海泉黄美娟
(西南林业大学园林园艺学院/国家林业和草原局西南风景园林工程技术工程研究中心/云南省功能性花卉资源及产业化技术工程研究中心/西南林业大学园林园艺花卉研发中心,云南 昆明 650224)
植物木质化是指木质素形成并沉积在细胞壁中的一种生物学过程[1,2],一般在次生细胞壁中发生,且木质素与植物的进化历程紧密相关,这可能对植物从水生环境登陆到陆地环境生活发挥着关键作用[3]。较高的木质化程度不仅可以提高植物的抗旱性[4],而且能提高植物的观赏价值。木质素是细胞壁的重要组分之一,主要在细胞次生壁中沉积,如导管、纤维和表皮等[5],具有硬度强、不溶水性以及不易被降解的化学特性,在植物生长和发育过程中起机械支撑作用,也是植物防御的屏障和水分运输所必需的[6-8]。关于木质素的合成调控已有研究表明,MYB46可直接对木质素途径进行调控[9];
小麦中的TaMYB[10]以及玉米中的ZmMYB46和ZmMYB31等[11]基因参与了调控木质素的生物合成;
火炬松(Pinus taedaL.)中的MYB4[12]能与木质素合成基因的启动子区的AC元件结合;
桉树(Eucalyptus grandis)中的MYB2会下调结构基因CCR的表达[13],推测会抑制木质素的生物合成;
除此之外,AtWRKY12可与NST2的启动子区域结合,进而负调控植物细胞中木质素的表达[14]。MYB、NAC和WRKY类转录因子都参与了木质素的表达调控,但尤以MYB转录因子报道得最多。
按照MYB结构域数目,MYB类转录因子被分为R1-MYB、R2R3-MYB、R1R2R3-MYB以及4R的MYB[15]。已有众多研究表明MYB4的N端具有特定的R2、R3结构域,因此可以推测其属于R2R3-MYB转录因子。在木质素合成调控网络中,郭亚玉等[16]认为SND1S作用于MYB转录因子,其中MYB转录因子不仅可以作为转录激活因子,还可以作为转录抑制因子来调控木质素的合成。MYB4转录因子通过参与木质素的调控过程而影响植物木质部细胞壁的加厚,如在转BpMYB4基因拟南芥(Arabidopsis thaliana)植株中木质素含量降低,因此BpMYB4可作为木质素生物合成的抑制因子[17];
Shen等[18]研究表明,在烟草和柳枝稷中过表达PvMYB4基因,木质素含量显著减少,从而影响其生长发育质量;
拟南芥的MYB4转录因子会抑制木质素的合成,其同源基因MYB32和MYB7则负调控木质素的相关合成途径[19,20]。由此可见MYB4转录因子在植物中的过表达可能负调控植物木质素的合成,进而影响植物的木质化程度及次生细胞壁加厚。
凤仙花属植物具有经济、药用、观赏和园艺价值[21]。绿萼凤仙花(Impatiens chlorosepala)是凤仙花科(Balsaminaceae)凤仙花属(Impatiens)的一年或多年生植物,生于山谷水旁阴处或疏林溪旁,其花形奇特,花淡黄色或橘黄色,低矮,分枝能力强,茎肉质实心。绿萼凤仙花观赏价值极高,可以作为园林地被植物予以开发。木质素含量能影响植株木质化程度,木质化程度高的植物株型挺拔、抗逆性强、观赏价值高。迄今为止,国内外尚未见有关绿萼凤仙花木质素调控基因MYB4的相关报道。
本研究克隆了绿萼凤仙花MYB4基因,并对其序列进行相关分析;
在此基础上,采用qRTPCR探究其在绿萼凤仙花不同部位的表达模式,进而探究MYB4基因在木质素合成过程中的功能和作用,以期为进一步研究绿萼凤仙花中MYB4基因在木质素合成中的分子机制提供理论支持,并为后期增加凤仙花木质化程度及品种改良提供基础数据。
1.1 试验材料
绿萼凤仙花于2020年7月种植于西南林业大学树木园温室大棚,2021年10月取其生长健壮的根尖、地上5 cm的茎基部及从上往下第四片成熟叶。
试剂材料:RNA提取试剂盒(OMEGA)、凝胶回收试剂盒(昆明硕阳科技有限公司)、逆转录试剂盒(昆明云科生物技术有限公司)、DH5α菌株(TAKARA)、pMD19-T载体(TAKARA)等。引物由生工生物工程(上海)股份有限公司合成。
1.2 试验方法
1.2.1 总RNA的提取与MYB4基因的克隆 根据RNA提取试剂盒说明书提取绿萼凤仙花根、茎和叶的总RNA;
采用逆转录试剂盒将RNA逆转录成cDNA,-20℃保存备用。使用课题组已有的转录组数据对绿萼凤仙花MYB4基因设计特异性引物,详见表1。以逆转录后的cDNA第一链为模板进行扩增,扩增体系(50μL):10×Easy TaqBuffer(Mg2+)6μL,dNTP 4μL,Easy TaqDNA Polymerase 0.5μL,上下游引物各2.5μL,cDNA 2.5 μL,ddH2O 32μL。扩增程序:95℃5 min;
95℃50 s,55℃1 min,72℃1 min,35个循环;
72℃10 min。对目的片段进行回收并纯化后克隆连接到pMD19-T载体上,转化大肠杆菌DH5α感受态细胞后,挑选阳性克隆进行验证、测序。

表1 绿萼凤仙花MYB4基因cDNA序列扩增引物
1.2.2MYB4基因序列分析 运用ExPasy-Prot-Param软件对MYB4基因编码的蛋白质进行理化性质分析;
利用CDD工具对目的基因的结构域进行预测;
使用BLAST功能找出与绿萼凤仙花MYB4基因同源性相对较高的其他植物的氨基酸序列,通过DNAMAN软件完成相关序列的同源性分析,并使用MEGA 7.0构建系统进化树。
1.2.3MYB4基因表达模式分析 将绿萼凤仙花根、茎和叶3个部位的RNA逆转录为cDNA并稀释10倍备用。设计qRT-PCR引物(表2),qRTPCR扩增体系(20μL):qPCR SYBR Green Master Mix 10μL,ddH2O 8.2μL,上下游引物各0.4μL,cDNA 1μL。扩增程序:95℃5 min;
95℃15 s,60℃30 s,72℃1 min,40个循环;
95℃15 s,60℃1 min,95℃15 s。内参基因为IcActin,每个样品3个重复,并将根定义为1个单位作为对照,采用2-△△Ct对目的基因在根、茎和叶3个部位的相对表达量进行计算,利用SPSS对其进行显著性分析。

表2 绿萼凤仙花MYB4基因qRT-PCR扩增引物
2.1 绿萼凤仙花MYB4基因的克隆
通过PCR扩增,获得IcMYB4-1、IcMYB4-2和IcMYB4-3基因全长cDNA序列,分别为666、888、771 bp(图1),编码221、295、256 aa。将其cDNA序列与基因组gDNA比较发现,IcMYB4-1、IcMYB4-2和IcMYB4-3基因组序列均在ATG下游263 bp处含有长度分别为83、107、117 bp的内含子。
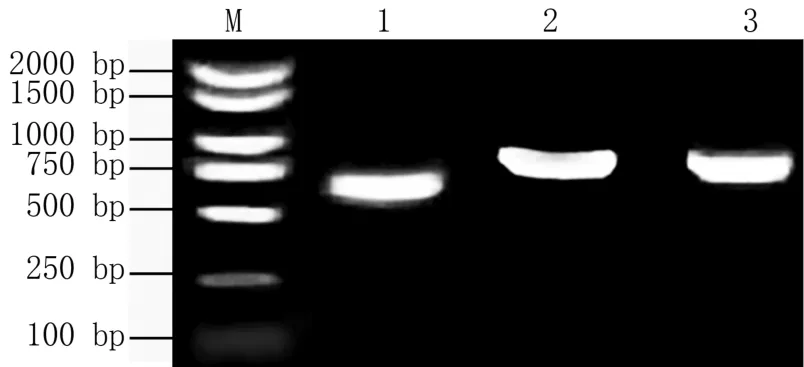
图1 绿萼凤仙花MYB4基因PCR扩增结果
2.2 绿萼凤仙花MYB4基因的序列结构分析
绿萼凤仙花MYB4基因编码蛋白质的基本理化性质分析结果(表3)表明,IcMYB4-1、IcMYB4-2和IcMYB4-3的不稳定指数均高于40,为不稳定蛋白,平均亲水指数为负值,属于亲水性蛋白。通过CDD工具分析结果表明,3个MYB4蛋白均属于MYB超家族蛋白成员,具特有的SANT结构域和稳定的PLN03091结构域(图2)。
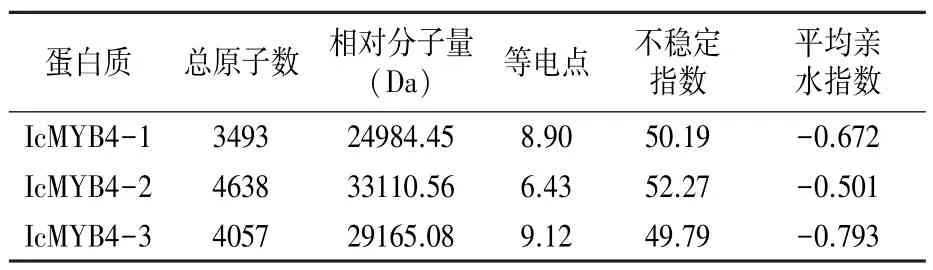
表3 绿萼凤仙花MYB4蛋白质的理化性质
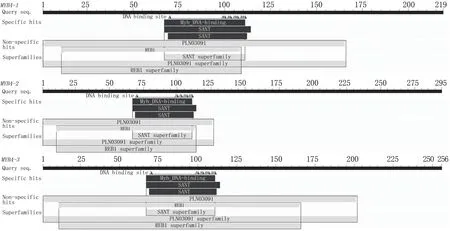
图2 绿萼凤仙花MYB4蛋白质的保守结构域
2.3 绿萼凤仙花MYB4基因的同源性及系统进化分析
对绿萼凤仙花及其他物种MYB4基因的氨基酸序列进行分析,结果表明,IcMYB4-1、IcMYB4-2和IcMYB4-3与其他物种的相似性在62%左右(图3)。N端存在保守的R2和R3 DNA结合结构域,同源性较高;
C端同源性相对较低,且同时具有抑制型的保守基序EAR。系统亲缘关系结果(图4)表明,进化树分为两大分支,IcMYB4-1和IcMYB4-2处于一个分支,推测其可能为直系同源关系,而IcMYB4-3与前两者分属两个分支,推测其可能为旁系同源关系。
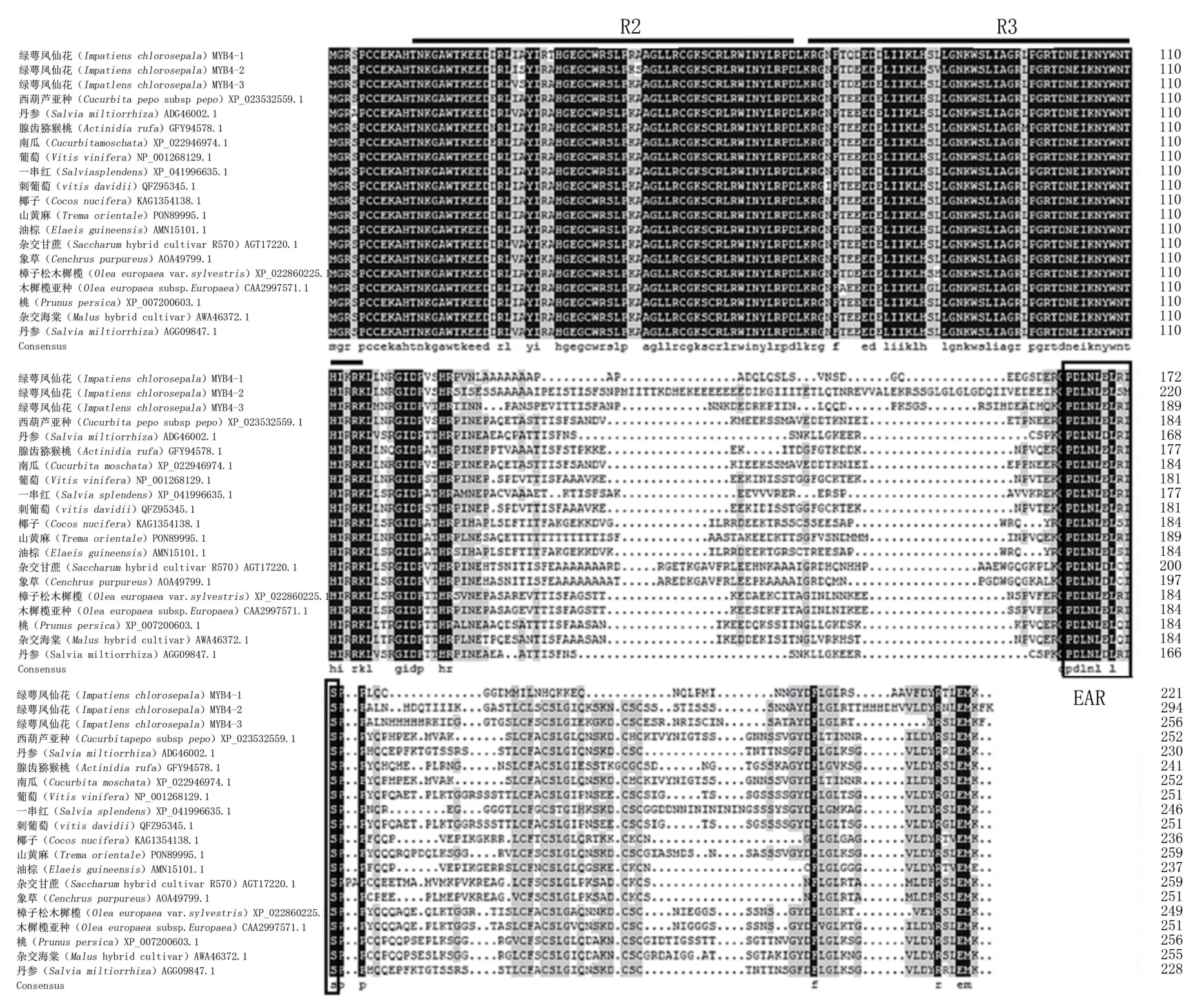
图3 MYB4基因的同源氨基酸序列比对

图4 基于绿萼凤仙花MYB4基因氨基酸序列构建的系统发育树
2.4 绿萼凤仙花MYB4基因的表达分析
研究发现,3个IcMYB4基因在绿萼凤仙花的3个不同部位(根、茎和叶)均有表达(图5)。以根为参照,IcMYB4-1在绿萼凤仙花不同部位的表达均为最低,表现为在根中最多,叶次之,茎最少;
IcMYB4-2和IcMYB4-3基因在绿萼凤仙花不同部位的表达趋势一致,表现为在根、茎和叶中依次升高。在绿萼凤仙花的3个不同部位中,根木质化程度相对较高,含木质素较多,而叶含木质素较少,推测IcMYB4-1基因可能对绿萼凤仙花木质素合成起正调控作用,而IcMYB4-2和IcMYB4-3对绿萼凤仙花的木质素合成起负调控作用。
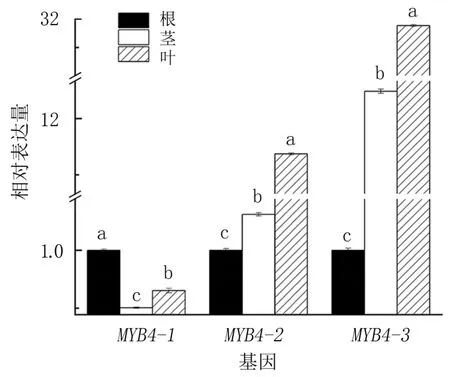
图5 MYB4基因在绿萼凤仙花3个不同部位的表达模式分析
MYB转录因子参与了植物的整个生长过程及其响应生物和非生物胁迫的过程[22]。在MYB家族中,R2R3-MYB蛋白在木质素合成及次生壁增厚等方面发挥着重要作用[23,24]。本研究从绿萼凤仙花中成功克隆了木质素合成相关转录因子IcMYB4-1、IcMYB4-2和IcMYB4-3,cDNA全长分别为666、888、771 bp,编码221、295、256 aa,均属于不稳定亲水性蛋白,与李嘉哲等[25]在山新杨中的研究结果一致;
且都含有一个内含子,与赵佳等[26]对月季花青素相关R2R3-MYB蛋白的研究结果一致。3个MYB4蛋白均属于MYB超家族蛋白成员,含有MYB家族R2和R3的DNA结合结构域,在N端同源性较高,C端差异较大,并且存在保守抑制型基序EAR[27],与已有研究结果一致[28];
IcMYB4-1、IcMYB4-2和IcMYB4-3与其他物种MYB4基因的氨基酸序列同源性在62%左右。上述研究均证明在各物种之间MYB转录因子的DNA结构域是高度保守的[29]。系统进化分析表明IcMYB4-1和IcMYB4-2处于一个分支,推测其可能为直系同源关系;
而IcMYB4-3与前两者分属不同分支,因此推测可能为旁系同源关系。
已有研究表明,MYB4基因在不同植物中的拷贝数不同,且在大多数植物的各个部位均有表达;
即使在同一物种,不同部位的表达量也具有显著差异。例如在茶树两个MYB转录因子的克隆及功能验证中,CsMYB4-5与CsMYB4-6都在根中表达量较高,在茎中表达量较低[30]。本研究分析发现,IcMYB4-1、IcMYB4-2和IcMYB4-3在绿萼凤仙花的3个部位均有表达;
其中,IcMYB4-1的表达量在根中最多,茎和叶的表达量较少,与李嘉哲等[25]的研究结果一致;
IcMYB4-2和IcMYB4-3的表达趋势一致,均为在叶中最多,茎次之,根最少,与对当归MYB4转录因子的研究结果一致[31]。以上结果表明,MYB4转录因子在不同植物甚至是同一植物的不同部位中可能发挥着不一样的功能和作用。
有研究证明小麦的TaMYB4转录因子在烟草中异源过表达时,其总木质素含量下降[10];
象草PpMYB4基因在烟草中过表达时,转基因烟草的木质素含量显著低于野生型[13]。这些研究表明MYB4基因在木质素的合成调控中起到了抑制作用。在山新杨中PdPapMYB4在木质化茎中大量表达,远高于幼茎[25],说明MYB4基因可能在不同植物中对木质素的调控作用不同。IcMYB4基因在绿萼凤仙花的木质素合成调控中起到了重要的作用,但其具体调控机制和功能还需进一步验证。









