313.15,K下三元体系KH2PO4-(NH2)2CO-H2O相平衡研究
时间:2023-02-28 13:50:05 来源:柠檬阅读网 本文已影响 人 
邓文清,朱 静,樊小娟,陈 艳,李天祥
(贵州大学化学与化工学院,贵州贵阳 550025)
N、P、K作为单体化肥的主要组成元素,在农 业、林业发展方面起着重要的促进作用[1-2]。近年来,由于传统N、P、K物理混合肥料存在的利用率低、稳定性差等缺点,导致了资源的严重浪费,因此生产一种高效的多组分水溶性肥料迫在眉睫[3-5]。水溶肥作为一种能完全溶于水的肥料,具有储存方便、效率高等优点[6-7]。生产多组分水溶性肥料的方法主要有化学和物理两种方法,其中化学方法主要采用共结晶法。溶液共结晶指的是在多组分溶液中利用溶质溶解度与温度的关系使溶质共晶析出,该方法生产的水溶性肥料具有稳定性高、流动性好、混合均匀等优点,因此得到了广泛的重视[8-11]。
利用共结晶技术生产多组分水溶肥的前提条件是具备多温度、多组分体系下的相平衡数据[12-13]。且多元体系的相平衡研究是结晶等许多化工分离过程的基础,可以定量描述在一定条件下物质组成与温度间的关系,广泛应用于化工、材料、冶金等领域。为了给四元体系NH4H2PO4-KH2PO4-(NH2)2CO-H2O的共结晶研究提供基础相平衡数据,作者所在的课题组研究人员对该体系及其子体系在多个温度下的相平衡进行了研究。如王肖丽等[14]研究了四元体系NH4H2PO4-KH2PO4-(NH2)2CO-H2O在298.15 K下的相平衡;
黄林川等[15]研究了三元体系KH2PO4-(NH2)2CO-H2O在283.15 K下的相平衡;
杨家敏等[16]研究了KH2PO4-NH4H2PO4-H2O在283.15 K下的相平衡。对于四元体系NH4H2PO4-KH2PO4-(NH2)2CO-H2O在313.15 K下的相平衡研究仅于梅[17]、EYSSELTOVÁ[18]报 道 了 其 子 三 元 体 系KH2PO4-NH4H2PO4-H2O、NH4H2PO4-(NH2)2CO-H2O的数据,而三元体系 KH2PO4-(NH2)2CO-H2O 在313.15 K下的相平衡数据未见文献报道。因此本文对该体系在313.15 K下的相平衡进行了研究,测定了溶解度数据并绘制了该三元体系的等温相图,同时采用Wilson和NRTL模型关联了溶解度数据。
1.1 药品及仪器
实验药品:KH2PO4、(NH2)2CO、对二甲氨基苯甲醛、钼酸铵、抗坏血酸,实验中所用药品皆为分析纯,纯度≥99%;
去离子水为自制,电阻率为18.25 MΩ·cm。
实验仪器:电子天平(HX-T,0.000 1 g);
恒温振荡器(SHA-2,0.1 K);
紫外可见分光光度计(TU-1810);
X射线衍射仪(X′Pert3Powder);
电热鼓风干燥箱(GZX-9146MBE);
同步热分析仪(NETZSCHSTA 499 F3)。
1.2 实验方法
实验采用等温溶解平衡法测定了三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下的溶解度数据。于250 mL的锥形瓶中,在次一级饱和溶液中加入一定质量的另外一种物质,并将锥形瓶置于313.15 K(±0.1 K)恒温振荡器中持续振荡,在充分溶解至平衡后取上层清液及对应固相进行分析。上层清液用钼锑抗比色法[19]和对二甲氨基苯甲醛比色法[20]分别测量H2PO4-、(NH2)2CO的含量(3次平行实验取平均值,平均偏差<0.50%);
固相采用湿渣法[21]和X射线衍射法共同鉴定其组成。
1.3 平衡确定
按照实验操作步骤进行投样,在样品于恒温振荡器中溶解4 h后,间隔1 h进行取样分析,当前后两次分析结果相对误差小于0.50%时,认为体系溶解至平衡。经过前期探索实验得知三元体系的平衡时间为6 h。
2.1 三元体系KH2PO4-(NH2)2CO-H2O的相平衡研究
实验测定了三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下的溶解度数据,列于表1。利用表1的溶解度数据绘制了对应的等温相图,如图1所示。图1中三角形的顶点A、B、C分别代表纯物质H2O、KH2PO4、(NH2)2CO,点D、F分别代表(NH2)2CO 和KH2PO4在水中的饱和溶解度。由表1和图1可知,三元体系KH2PO4-(NH2)2CO-H2O为简单共饱和型体系,体系存在一个共饱和点E,两条单变量曲线DE、FE,其中DE是以KH2PO4为单变量的溶解度曲线、FE是以(NH2)2CO为单变量的溶解度曲线。

图1 三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下的等温相图Fig.1 Isothermal phase diagram of ternary system of KH2PO4-(NH2)2CO-H2O at 313.15 K

表1 三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下的溶解度数据Table 1 Solubility data of ternary system of KH2PO4-(NH2)2CO-H2O at 313.15 K
研究发现三元体系KH2PO4-(NH2)2CO-H2O溶解至平衡后,共饱和点E的液相组成为:w(KH2PO4)=6.96%、w[(NH2)2CO]=60.99%、w(H2O)=32.05%,此时KH2PO4的溶解度由二元饱和点的33.50 g降至三元饱和点的21.82 g,表明(NH2)2CO对KH2PO4有较强的盐析作用,两条单变量曲线将等温相图划分为4个区域,分别是(NH2)2CO和KH2PO4的混合结晶区(Ⅰ)、(NH2)2CO的结晶区(Ⅱ)、不饱和区(Ⅲ)、KH2PO4的结晶区(Ⅳ)。对比可知结晶区面积由大到小依次为:Ⅳ、Ⅰ、Ⅱ,且同等温度下(NH2)2CO的溶解度远远大于KH2PO4,所以在三元体系KH2PO4-(NH2)2CO-H2O相图中KH2PO4有最大的结晶区面积,混合晶体[(NH2)2CO和KH2PO4]的结晶区面积次之,(NH2)2CO的结晶区面积最小。
图2为三元体系KH2PO4-(NH2)2CO-H2O在共饱和点E处平衡固相的XRD谱图。由图2可知,平衡固相XRD谱图的峰值与(NH2)2CO和KH2PO4标准谱图所在的峰值一一对应,表明平衡固相仅仅是两种物质间简单的物理混合,未形成复盐和固溶体。

图2 三元体系KH2PO4-(NH2)2CO-H2O共饱和点E的X射线衍射谱图Fig.2 XRD patterns of co⁃saturation point E of ternary system of KH2PO4-(NH2)2CO-H2O
2.2 三元体系KH2PO4-(NH2)2CO-H2O在多个温度下的相图对比
283.15 K[15]、313.15 K、353.15 K[22]下三元体系KH2PO4-(NH2)2CO-H2O相图见图3。由图3可知:(NH2)2CO与KH2PO4的溶解度随着温度的升高而逐渐增大,且在3个温度下其溶解度相图具有相似的组成结构。在283.15 K至313.15 K的温度区间内,(NH2)2CO与混合晶体[(NH2)2CO和KH2PO4]的结晶区随着温度的升高而逐渐变小、KH2PO4的结晶区随着温度的升高而逐渐增大。表明在中低温区间内冷却结晶过程中有利于(NH2)2CO与混合晶体[(NH2)2CO和KH2PO4]的结晶、不利于KH2PO4的结晶。在313.15~353.15 K,(NH2)2CO的结晶区面积逐渐变大,而KH2PO4的结晶区面积逐渐变小。表明在高温区间内,随着KH2PO4在三元体系KH2PO4-(NH2)2CO-H2O中质量占比的增加,对(NH2)2CO的溶解产生了一定的抑制作用,导致共饱和点处(NH2)2CO的占比较313.15 K时有所减少。
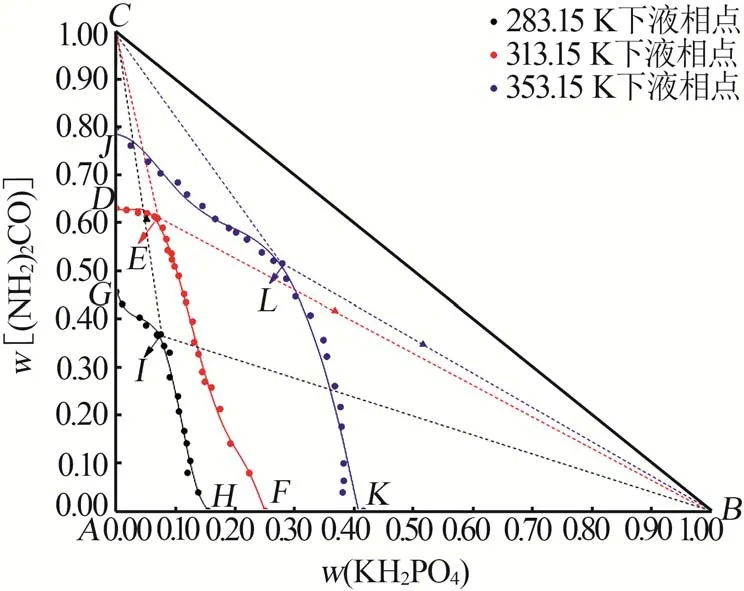
图3 三元体系KH2PO4-(NH2)2CO-H2O在283.15、313.15、353.15 K下对比相图Fig.3 Phase diagrams of ternary system of KH2PO4-(NH2)2CO-H2O at 283.15 K,313.15 K and 353.15 K
2.3 三元体系KH2PO4-(NH2)2CO-H2O的溶解度关联计算
Wilson和NRTL模型都是描述溶液中活度系数与溶质物质的量分数的关系式。为了计算活度系数,同时考虑到体系中存在电解质与非电解间的相互作用,本文采用Wilson和NRTL模型对实验数据进行关联计算,固液相平衡的方程表达式[23]为:

式中:xi表示组分i在液相中的物质的量分数;
γi表示组分i在液相中的活度系数;
R表示气体常数,8.314 J/(mol·K);
T表示实验温度,K;
ΔH表示熔化焓,J/mol;
Tm表示熔点,K。ΔH和Tm可以通过同步热分析仪进行测量。
2.3.1 Wilson模型
Wilson模型[24]可以准确描述极性和非极性混合物质的活度系数关系,但该模型仅适用于完全互溶体系,不适用于液液部分互溶体系。其表达式为:

式中:N表示实验点的个数;
i、j、k表示组分;
Λij为Wilson模型参数,Λij≠Λji,Λii=Λjj=1;
gij为二元交互作用能量参数;
Vi、Vj为组分i、j的摩尔体积,L/mol。
2.3.2 NRTL模型
NRTL模型[25]是在Wilson模型的基础上进一步发展起来的,适用于部分互溶体系及完全互溶体系。其表达式为:

式中:α表示模型可调参数,本文取0.3;
λ表示二元相互作用能量参数;
G、τ表示NRTL模型参数。
为了使Wilson和NRTL模型的二元参数更加准确地应用到多元体系中,拟合盐与水之间的作用参数时,在两种模型中引入了参数a、b,表达式[26]为:


对溶解度的关联计算值采用RMSD(均方差)和RAD(相对平均偏差)判断模型的适用性,RMSD和RAD方程表达式[27]为:

目标函数为:

式中:wei为组分i的质量分数实验值;
wical为组分i的质量分数计算值。
KH2PO4、(NH2)2CO在多个温度下的溶解度数据见文献[28-29],为了得到KH2PO4-H2O、(NH2)2COH2O之间的二元相互作用参数,本文利用1st-Opt软件中的麦夸特法(Levenberg-Marquardt)结合通用全局优化法进行迭代计算,采用Wilson和NRTL方程的二元展开式分别拟合了KH2PO4、(NH2)2CO在多个温度下的溶解度数据。将盐与水的二元参数及实验测得的溶解度数据带入Wilson和NRTL方程的三元展开式中,迭代计算得到盐与盐之间的二元相互作用参数及溶解度的关联计算值。KH2PO4与(NH2)2CO的理化性质见表2[其中KH2PO4为自测,(NH2)2CO来源于文献[13]],物质间二元相互作用参数见表3,三元体系KH2PO4-(NH2)2CO-H2O的关联计算值见表4。

表2 物质的理化性质Table 2 Physical and chemical properties of substances

表3 三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下Wil⁃son、NRTL二元相互作用参数Table 3 Wilson and NRTL binary interaction parameters of ter⁃nary system of KH2PO4-(NH2)2CO-H2O at 313.15 K

表4 三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下Wilson和NRTL模型关联计算值Table 4 Wilson and NRTL model correlated calculation values of ternary system of KH2PO4-(NH2)2CO-H2O at 313.15 K
由关联计算结果可知:Wilson模型和NRTL模型关联三元体系KH2PO4-(NH2)2CO-H2O的RAD、RMSD分别为3.34%、0.17%和10.53%、0.38%,说明两种模型能较好地适用于本文的电解质与非电解质组成的溶液体系中。
采用等温溶解平衡法研究了三元体系KH2PO4-(NH2)2CO-H2O在313.15 K下的相平衡,并对比了该体系在283.15、313.15、353.15 K下的溶解度相图。结果表明:三元体系KH2PO4-(NH2)2CO-H2O在3个温度下皆属于简单体系且具有相似结构的溶解度相图,相图中均含有1个共饱和点、2条单变量曲线、3个结晶区;
体系溶解至平衡的过程中未有复盐及固溶体生成。随着温度的升高,KH2PO4、(NH2)2CO的溶解度逐渐增大,在中低温区间内(NH2)2CO对KH2PO4存在较强的盐析作用,降低温度有利于(NH2)2CO的结晶析出;
当温度升至高温阶段后,随着KH2PO4在体系中质量占比的增加,KH2PO4对(NH2)2CO的溶解产生了一定的抑制作用。本研究为后续四元体系NH4H2PO4-KH2PO4-(NH2)2CO-H2O的相平衡及冷却结晶生产多组分水溶肥的研究奠定了必要的理论基础。
采用Wilson和NRTL模型对三元体系KH2PO4-(NH2)2CO-H2O的溶解度数据进行关联计算,Wilson模型的RAD和RMSD分别为3.34%、0.17%;
NRTL模型的RAD和RMSD分别为10.53%、0.38%。关联计算值与实验值基本吻合,表明两个模型都能较好地应用到本文电解质与非电解质组成的三元体系中。









