有氧运动对APP/PS1小鼠海马内质网应激--细胞自噬偶联的影响
时间:2022-11-18 10:00:04 来源:柠檬阅读网 本文已影响 人 
夏 杰,赵 娜,王 璟,李百侠,徐 波*
(1.华东师范大学 体育与健康学院,上海 200241;
2.华东师范大学“青少年健康评价与运动干预”教育部重点实验室,上海 200241)
阿尔茨海默病(Alzheimer’s disease,AD)是一种起病隐袭、呈进行性发展的神经退行性疾病,临床特征主要为认知障碍、精神行为异常和社会生活功能减退(中华人民共和国国家卫生健康委员会,2020)。2020年数据显示,中国60岁及以上的人群中,AD患者达到983万例,轻度认知障碍患病高达3 877万人(Jia et al.,2020)。然而目前临床上尚缺乏对AD有效的治疗药物或手段,其发病机制和治疗措施尚需进一步探究。流行病学研究表明,运动可以降低老年人认知能力下降和患老年痴呆症的风险(Hamer et al.,2018;
Livingston et al.,2017)。然而,运动干预AD的作用机制尚不清楚。
近年来的研究认为,AD属于蛋白质稳态失衡的疾病,主要表现为蛋白质错误折叠和异常蛋白质清除途径受 损(Boland et al.,2018;
Hipp et al.,2019;
Uddin et al.,2021)。和是AD发病的2个关键基因,的突变可能导致该基因在蛋白合成过程中错误折叠增加;
突变可导致内质网蛋白质稳态失衡(Ryazantseva et al.,2018;
Tong et al.,2016)。因此,和基因突变可能是导致AD脑内蛋白质稳态失衡的关键。内质网是调控蛋白质稳态的重要细胞器,当内质网中错误折叠蛋白质累积时,内质网应激(endoplasmic reticulum stress,ERS)被诱导并启动未折叠蛋白反应(unfolded protein response,UPR),通过抑制蛋白质合成和促进降解等途径恢复内质网蛋白质稳态(Hetz et al.,2017)。细胞自噬是神经细胞UPR激活的主要降解途径,该功能失调与AD发病密切相关(Nijholt et al.,2011)。蛋白激酶样内质网激酶(protein kinaselike endoplasmic reticulum kinase,PERK)/真核翻译起 始 因 子 2α(eukaryotic translation initiation factor2α,eIF2α)是UPR中的关键信号,在AD病理机制中发挥重要作用。研究发现,AD患者和动物模型脑内存在ERS和PERK/eIF2α 过度激活(Murray et al.,2020;
Oliveira et al.,2021)。进一步研究认为,AD脑内表现为过度激活的PERK/eIF2α和无效的细胞自噬,这说明AD脑内可能存在ERS-细胞自噬途径异常(Cai et al.,2016a)。因此,靶向调节ERS和细胞自噬途径可能是缓解AD病理的有效途径。钙网蛋白(calreticulin,CRT)是一种内质网分子伴侣,在蛋白质折叠和质量控制发挥作用。近期研究显示,CRT在ERS状态下表达增加,并可通过与微管相关蛋白轻链3(microtubule-associated proteins light chain 3,LC3)结合偶联ERS与自噬,并认为激活CRT-细胞自噬信号的药理学或遗传学方法可能具有调节ERS及其相关疾病的潜力(Yang et al.,2019)。研究已证实,AD 患者脑内 CRT的mRNA水平和蛋白水平均有所降低(Taguchi et al.,2000);
血清CRT水平可作为AD患者诊断的生物标志物(Lin et al.,2014)。因此,本研究推测CRT介导的ERS-细胞自噬偶联可能参与AD病理机制。
运动科学领域研究发现,运动可以缓解糖尿病小鼠、卒中大鼠和AD小鼠脑组织的ERS(Cai et al.,2016b;
Hong et al.,2020;
Li et al.,2021)。报道的一项研究发现,有氧运动诱导分泌的Irisin可以阻止Aβ寡聚体导致的ERS相关分子表达升高(Lourenco et al.,2019)。本课题组前期研究发现,有氧跑台运动可以缓解APP/PS1小鼠海马的ERS、下调PERK/eIF2α信号和提高自噬活性(赵娜 等,2019;
Xia et al.,2019)。这提示,运动可能调节AD模型小鼠脑内ERS和细胞自噬。然而,ERS与细胞自噬在运动改善AD病理中的交互调控机制尚需深入探讨。
基于此,本研究从ERS与细胞自噬偶联的角度,探究3个月的中等强度有氧运动对APPswe/PS1dE9(APP/PS1)小鼠海马Aβ病理、ERS、细胞自噬以及ERS-细胞自噬偶联的影响,以阐明运动调节APP/PS1小鼠海马ERS-细胞自噬偶联机制。
1.1 实验动物及分组
C57BL/6系的雄性 APPswe/PS1dE9(APP/PS1)转基因小鼠及雄性野生型(Wild Type,WT)小鼠购自南京大学模式动物研究所。所有小鼠在控制温度(22±2)℃、湿度50%±10%和12 h的明暗循环条件中饲养,自由摄取水和饲料。自3月龄开始,将APP/PS1转基因小鼠和WT小鼠分为4组:野生型对照组(WT-Sed,=11)、野生型运动组(WT-Exe,=11)、APP/PS1对照组(APP/PS1-Sed,=11)和APP/PS1运动组(APP/PS1-Exe,=11)。本实验经华东师范大学实验动物保护与使用委员会批准(m20190405)。
1.2 运动方案

1.3 取材
实验干预结束后,每组取5只小鼠,进行深度麻醉(i.p.10%水合氯醛,3.5 mL/kg体质量),经心脏灌注预冷的PBS,随后取脑组织。将左侧半脑的海马组织取出,提取组织总RNA,用于Real-time PCR实验。将右侧半脑置于多聚甲醛(4%)中进行固定,于次日进行脱水、包埋、制成石蜡切片(4 μm),用于免疫组化和免疫荧光实验。每组另取6只小鼠,经深度麻醉后处死,剥离左右双侧海马,提取组织总蛋白,用于Western blotting和Simple western实验。
1.4 蛋白质样品制备
使用含有蛋白磷酸酶抑制剂的RIPA裂解液提取海马组织总蛋白。简明操作步骤如下:将海马组织(20 mg)装入含有500 μLRIPA裂解液的匀浆管中,装入3颗磁珠。以3.55 m/s的速度进行匀浆,匀浆时间为30 s,重复3次。匀浆结束后,在4℃条件下以12 000 g的速度离心10 min,收集上清液。采用BCA试剂盒测定蛋白浓度,收集的蛋白质样品用于Western blotting和Simple western实验。
1.5 Western blotting
Western blotting按以下步骤进行:将提取的蛋白质样品与5×SDS-PAGE蛋白上样缓冲液混合,使最终浓度为5 μg/μL。在95 ℃条件下变性5 min,制成Western blotting待测样本。随后依次进行上样、电泳、转膜、封闭、孵育一抗、孵育二抗、显影等步骤。最后采用FluorChem FC2软件计算条带的灰度值,以β-Actin为内部参照,计算出目标蛋白的相对表达量。抗体信息如下:LC3(1∶1 000,Affinity,AF5402)、P62(1∶1 000,Affinity,AF5384)、β-Actin(1∶1 000,Affinity,T0022)、HRP标记的山羊抗兔(1∶3 000,Affinity,S0001)。
1.6 Simple western
Simple western实验采用Wes全自动蛋白表达分析系统(ProteinSimple,美国)进行。采用ProteinSimple公司提供的试剂盒(12-230kDa Wes Separation Module 8×25 capillary cartridges,SM-W004)和二抗(Anti-Rabbit Detection Module for Wes,DM001)完成实验。简明操作步骤如下:1)准备蛋白质样品。将提取的蛋白质样本进行BCA定量,将蛋白浓度稀释为5 μg/μL。2)准备Wes仪器并运行开机自检程序。3)加样。首先配置DTT、5×Master Mix(即Loading Buffer)、Ladder(即分子量标准品)、样品(检测常规蛋白和磷酸化蛋白的样品终浓度分别为1.5 μg/μL和3 μg/μL)、抗体和发光液。开始加样,从ProteinSimple试剂盒里取出微孔板,将配制好的试剂依次加入微孔板的A~F行。加样完成后,盖上微孔板盖子,RT条件下2 500 r/min离心10 min,检查并确认微孔板的底部无气泡。4)上机操作。打开软件,按照说明书上的步骤设置运行参数。打开Wes仪的仓门,并将ProteinSimple试剂盒里的毛细管放入Wes仪器。将微孔板放入Wes仪器。关闭仓门,锁止后点击Start运行。5)运行结束和数据分析。运行结束后,依次完成检查荧光内参、Ladder、Sample,数据和图片导出等步骤。6)目的蛋白相对表达量的计算。对于常规蛋白,以GAPDH为内参蛋白,计算目的蛋白的相对表达量。对于磷酸化蛋白,则以该蛋白的总蛋白为内部参照,计算磷酸化蛋白的相对表达量。本实验使用的抗体信息如下:PERK(1∶50,Affinity,AF5304) 、p-PERK(1∶ 100,Affinity,DF7576)、eIF2α(1∶50,Affinity,AF6087)、p-eIF2α(1∶50,Affinity,AF3087)、ATF4(1∶50,Affinity ,DF6008)、CRT(1∶50,Affinity,DF6211)、GAPDH(1∶150,Affinity,AF7021)。
1.7 Real-time PCR
使用Trizol试剂提取海马组织总RNA。使用逆转录试剂盒将RNA反转录为cDNA。使用HieffqPCR SYBR Green Master Mix(Low Rox Plus)试剂盒(上海翊圣,11202ES03),按照 10 μL的 HieffqPCR SYBR Green Master Mix,7.6 μL蒸馏水,0.2 μL上游引物,0.2 μL下游引物,2 μL的cDNA样本,配制20 μL的反应体系。在QuantStudio3 and 5 Real-time PCR系统上完成检测。根据检测的Ct值,以为内参基因,采用2的方法计算出目的基因mRNA相对表达量。基因引物序列如下:(F:AATGTGTCCGTCGTGGATCTGA;
R:AGTGTAGCCCAAGATGCCCTTC)、(F:AAGGTACAAGGGAGTGGGTG;
R:ACCCGGAATACCCTAGACCT)、(F:AGGTAACCCAACGCCTTCTT;
R:GAGACGAGAGCAAGGAATGG)、(F:GTCCCCAAGGAGGATGGTAT;
R:ACCAAGCCCATCTCAACATC)、(F:AACATTCGTTGCCCAAACTC;
R:TTTCATGCCCACAGTCACAT)、(F:CACCTGTGAGTGGGGCTAAT;
R:CACCTTGACTGGTCCCTTGT)。
1.8 免疫组织化学实验
1.8.1 Aβ染色
简明步骤如下:1)脱蜡至水。2)抗原修复。使用柠檬酸抗原修复缓冲液(pH:6.0)进行抗原修复。3)阻断内源性过氧化物酶。在含有3%(HO)的0.1 mol/L Tris-HCl缓冲盐水(pH:7.4)中处理10 min以抑制内源性过氧化物酶活性。4)BSA封闭。5)加一抗。一抗采用Anti-Aβ antibody(1∶1 000,Abcam,ab201060)。6)加二抗。采用HRP标记的山羊抗兔(1∶200,Servicebio,GB23303)。7)DAB显色。加入DAB显色液并控制显色时间,阳性为棕黄色。8)复染细胞核。苏木素复染、分化、返蓝。9)脱水封片。10)镜检。利用显微镜(Nikon,E100)和成像系统(Nikon,DS-U3)采集图像。11)图像分析。利用Image-Pro Plus 6.0(IPP 6.0)分析背侧海马齿状回(Dentate gyrus,DG)的Aβ斑块水平。
1.8.2 APP/GRP78、CRT/LC3免疫荧光双重标记
免疫荧光双重标记实验采用TSA荧光双重染色试剂盒(Servicebio,G1235-100T),按照说明书进行。简明步骤如下:1)脱蜡至水。2)抗原修复:EDTA抗原修复缓冲液(pH:8.0)进行抗原修复,并微波炉加热处理。3)画圈标记。4)滴加组织自发荧光淬灭剂(Servicebio,G1221)A液,室温孵育30 min。5)阻断内源性过氧化物酶:同步骤3。6)BSA封闭。7)一抗孵育:加入第一种一抗,Anti-GRP78 antibody(1∶50,Affinity,AF5366)、Anti-CRT antibody(1∶50,Affinity,DF6211),4 ℃孵育过夜。8)二抗孵育:HRP标记的山羊抗兔(1∶200,Servicebio,GB23303),室温孵育50 min。9)加TSA-FITC染色工作液,室温避光孵育10 min。10)微波处理:使用EDTA抗原修复缓冲液(pH:8.0)进行抗原修复,并进行微波炉加热处理。11)重复步骤7:加第二种一抗 ,Anti-APP antibody(1∶100,Affinity,AF7687)、Anti-LC3 antibody(1∶1 000,Affinity,AF5402),4℃孵育过夜。12)重复步骤8。13)滴加TSA-CY3染色工作液,室温避光孵育10 min。14)细胞核复染:滴加DAPI染色液,室温避光孵育10 min。15)组织自发荧光淬灭:加组织自发荧光淬灭剂B液,室温孵育5 min。16)封片及镜检:滴加抗荧光淬灭封片剂封片。采用荧光显微镜(Nikon Eclipse C1)和成像系统(Nikon DS-U3)采集图像。紫外激发下DAPI发蓝光,FITC发绿光,CY3发红光。17)图像分析。利用Image-Pro Plus6.0软件分析背侧海马DG区分子层(molecular layer,ML)APP与GRP78、CRT与LC3的荧光强度及共定位水平(Pearson’s correlation coefficient)。
1.9 生物信息学分析
利用生物信息学数据库iLIR Autophagy Database(Kalvari et al.,2014)(https://ilir.warwick.ac.uk/)对 CRT 蛋白序列进行分析,根据CRT蛋白序列中是否具有LIR motif(LC3结合区域)来预测该蛋白能否介导自噬。具体方法如下,利用 UniProt数据库(https://www.uniprot.org/)查询CRT的蛋白序列,将获得的CRT蛋白序列(FASTA格式)输入iLIR数据库中,进行LC3结合区域分析。
1.10 数据统计分析
采用双因素方差分析,以基因和运动作为两个因素,多重比较采用Bonferroni法。数据以平均值±标准误(±)形式呈现,统计学意义设为<0.05或<0.01。
2.1 运动对小鼠海马Aβ斑块水平的影响
采用免疫组化检测各组小鼠海马组织Aβ斑块水平,并利用IPP 6.0软件对Aβ染色进行光密度分析。结果如图1所示,与WT-Sed组相比,APP/PS1-Sed组小鼠海马Aβ斑块水平显著升高(<0.01)。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马Aβ斑块水平显著降低(<0.05)。
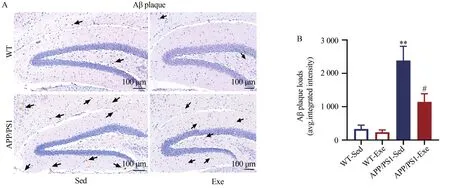
图1 APP/PS1转基因和运动对小鼠海马Aβ斑块水平的影响Figure 1.Effects of APP/PS1 Transgene and Exercise on Aβ Plaque in Mice Hippocampus
2.2 运动对小鼠海马APP/GRP78共定位水平的影响
采用免疫荧光技术对海马组织APP和GRP78进行免疫荧光染色,如图2A所示,荧光显微镜视野中的红色荧光为APP,绿色荧光为GRP78,蓝色荧光为细胞核。采用IPP 6.0软件对各组小鼠海马DG区APP/GRP78共定位水平、APP和GRP78的平均荧光强度进行分析。与WT-Sed组相比,APP/PS1-Sed组小鼠海马DG区APP/GRP78共定位水平显著升高(<0.01,图 2B)、APP(<0.05,图2C)和GRP78(<0.01,图2D)的平均荧光强度显著增加;
APP/PS1-Exe组小鼠海马DG区APP/GRP78共定位水平显著升高(<0.05,图2B)。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马DG区APP/GRP78共定位水平显著降低(<0.01,图2B),GRP78的平均荧光强度显著减少(<0.05,图2D)。

图2 各组小鼠海马APP和GRP78免疫荧光分析Figure 2.Immunofluorescence Analysis of APP and GRP78 in Mice Hippocampus
2.3 运动对小鼠海马PERK/eIF2α信号通路的影响
采用Simple western技术对小鼠海马组织PERK/eIF2α信号通路蛋白进行定量分析。如图3所示,与WT-Sed组相比,APP/PS1-Sed组小鼠海马p-PERK(<0.05,图3A、D)和 p-eIF2α(<0.01,图3B、D)的蛋白水平显著升高。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马p-PERK(<0.05,图3A、D)和p-eIF2α(<0.01,图3B、D)的蛋白水平显著降低。与WT-Sed组相比,APP/PS1-Sed组小鼠海马ATF4的蛋白水平显著升高(<0.01,图3C、D)。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马ATF4的蛋白水平显著降低(<0.01,图3C、D)。

图3 APP/PS1转基因和运动对小鼠海马PERK/eIF2α信号通路的影响Figure 3.Effects of APP/PS1 Transgene and Exercise on Hippocampal PERK/eIF2α Signaling in Mice
2.4 运动对小鼠海马自噬相关分子表达的影响
采用Real-time PCR检测了自噬相关基因的和的mRNA水平。如图4A~D所示,与WT-Sed组相比,WT-Exe组小鼠海马的mRNA水平显著升高(<0.01,图4B),的mRNA水平显著降低(<0.05,图4C);
APP/PS1-Sed组小鼠海马(<0.05,图4A)和(<0.01,图4C)的 mRNA水平显著降低,的mRNA水平显著升高(<0.05,图4D);
APP/PS1-Exe组的mRNA水平显著降低(<0.01,图4C),的 mRNA 水平显著升高(<0.01,图4D)。与WT-Exe组相比,APP/PS1-Exe组小鼠海马(<0.01,图4A)和(<0.01,图4B)的mRNA水平显著降低,的mRNA水平显著升高(<0.01,图4D)。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马的mRNA水平显著升高(<0.01,图4D)。

图4 APP/PS1转基因和运动对小鼠海马细胞自噬的影响Figure 4.Effects of APP/PS1 Transgene and Exercise on Autophagy in Mice Hippocampus
采用Western blotting技术检测了小鼠海马LC3和P62的蛋白水平。如图4E、F所示,与WT-Sed组相比,APP/PS1-Sed组小鼠海马LC3Ⅱ(<0.05,图4E)和P62(<0.05,图4F)的蛋白水平显著升高。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马P62的蛋白水平显著降低(<0.05,图4F)。
2.5 运动对小鼠海马CRT介导的ERS-细胞自噬偶联的影响
采用生物信息学数据库iLIR web server对CRT蛋白序列进行分析,如图5A所示,CRT蛋白序列的结合域(Pfam)存在LC3结合区,说明CRT可能介导细胞自噬。采用Real-time PCR技术和Simple western技术检测海马组织CRT的表达。如图5B、C所示,与WT-Sed组相比,APP/PS1-Sed组小鼠海马的mRNA水平(<0.01,图5B)和蛋白水平(<0.01,图5C)均显著降低。与WT-Exe组相比,APP/PS1-Exe组小鼠海马的mRNA水平显著降低(<0.05,图5B),而CRT的蛋白水平显著升高(<0.05,图5C)。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马CRT的蛋白水平显著升高(<0.05,图5C)。

图5 各组小鼠海马CRT和LC3免疫荧光分析Figure 5.Immunofluorescence Analysis of CRT and LC3 in Hippocampus of Mice
采用免疫荧光技术对海马组织CRT和LC3进行荧光染色,如图5D所示,荧光显微镜视野中观察到的绿色荧光为CRT,红色荧光为LC3,蓝色荧光为细胞核。采用IPP 6.0软件对各组小鼠海马DG区CRT/LC3共定位水平、CRT和LC3的平均荧光强度进行分析。分析结果显示,与WT-Sed组相比,APP/PS1-Sed组小鼠海马DG区CRT的平均荧光强度显著减少(<0.01,图5F),LC3的平均荧光强度显著增加(<0.01,图5G);
APP/PS1-Exe组小鼠海马DG区LC3的平均荧光强度显著增加(<0.01,图5G)。与APP/PS1-Sed组相比,APP/PS1-Exe组小鼠海马DG区CRT的平均荧光强度显著增加(<0.01,图5F)。
3.1 跑台运动减少APP/PS1小鼠海马内质网APP积累
瑞典突变型(APPswe)和基因 dE9突变(PS1dE9)是家族性AD中筛选出的2个突变基因。然而,和基因突变导致的AD病理发生机制目前尚不明确。因此,本研究采用表达APPswe和PS1dE9的双转基因小鼠探究AD的发病机制,并在此基础上探究运动干预的效果和分子机制。以往研究表明,APP/PS1小鼠自3月龄开始,Aβ生成逐渐增加,至6月龄时期已经形成Aβ斑块,并表现出学习记忆和认知缺陷(Zhou et al.,2020)。本研究发现,APP/PS1转基因导致小鼠在6月龄时期表现出海马Aβ斑块显著增加,而跑台运动可以显著降低APP/PS1小鼠海马Aβ斑块水平。因此,3个月的跑台运动可以预防APP/PS1转基因所诱导的AD标志性病理。
鉴于APP和PS1可定位于内质网,基因突变可以破坏内质网功能,而的突变可以引起其在合成过程中错误折叠的增加(Ryazantseva et al.,2018;
Tong et al.,2016)。因此,和基因突变导致的AD病理可能与ERS有关。GRP78是内质网中的伴侣分子,当内质网中错误折叠蛋白质增加,GRP78则合成增加并与错误折叠蛋白质结合,因此GRP78也是反映ERS的标志分子。有研究显示,在ERS状态下,GPR78可以与APP结合并将错误折叠的APP滞留在内质网中,进而促进APP在分泌途径早期在内质网积累(Kudo et al.,2006)。因此,本研究推测,APP/PS1转基因可能会导致APP在内质网中积累并导致ERS。为了验证这一假设,本研究采用免疫荧光染色检测了小鼠海马APP与GRP78的共定位水平和荧光强度。结果发现,APP/PS1转基因小鼠海马组织中APP和GRP78的荧光强度以及APP/GRP78的共定位水平增加。与本研究结果一致,Li等(2019)在APP/PS1小鼠海马组织中观察到APP和GRP78蛋白水平的一致上调。Plácido等(2015)对大鼠脑内皮细胞(RBE4)进行ERS诱导剂处理,发现RBE4中APP和GRP78蛋白水平,以及APP/GRP78共定位水平均提高。这提示,在本研究中,APP/PS1转基因可能增加了APP在小鼠海马内质网中的错误折叠,并导致ERS水平的升高。
研究表明,在转染APP突变的HEK293和COS7细胞中,内质网中APP的滞留与Aβ生成增加有关(Nishitsuji et al.,2009)。这提示,APP/PS1转基因引起的Aβ生成增加可能与APP在内质网中的滞留有关。本课题组前期研究发现,运动可以减少APP/PS1转基因导致的小鼠海马Aβ生成增加(Yu et al.,2021;
Zhang et al.,2022)。另有研究发现,游泳运动可以下调Aβ注射诱导的GRP78表达上调(刘涛,2012)。而本研究发现,跑台运动降低了APP/PS1小鼠海马GRP78的表达和APP/GRP78共定位水平,并减少了Aβ斑块水平。这提示,运动可减少APP/PS1小鼠海马Aβ生成,可能与APP在内质网中的积累减少有关。
3.2 跑台运动抑制APP/PS1小鼠海马PERK/eIF2α过度激活和细胞自噬异常
PERK/eIF2α是内质网中缓解ERS的关键信号,然而该信号在AD患者脑内过度激活(Murray et al.,2020)。本研究在APP/PS1小鼠海马中发现p-PERK和p-eIF2α水平增加,这说明PERK/eIF2α通路过度激活与AD的发病机制有关。与本研究一致,Wu等(2021)在APP/PS1小鼠脑内发现PERK/eIF2α信号通路的过度激活。然而,本研究发现跑台运动降低了APP/PS1转基因小鼠海马p-PERK和p-eIF2α 的蛋白水平,提示运动可能抑制了 PERK/eIF2α 信号通路的过度激活。以往研究显示,12周的自主跑轮运动可抑制PS2突变小鼠海马PERK/eIF2α过度激活介导的神经细胞凋亡(Kang et al.,2013)。抑制PERK信号通路还参与了运动对卒中小鼠的神经保护作用(Li et al.,2021)。课题组前期研究显示,跑台运动抑制APP的淀粉样蛋白生 成途径与 PERK/eIF2α 信 号 的下调有关(Xia et al.,2019)。因此,抑制PERK/eIF2α信号通路过度激活可能是运动预防AD的潜在作用途径。
研究发现,PERK/eIF2α信号通路可以调控细胞自噬,PERK/eIF2α的下游分子ATF4和CHOP可介导自噬基因转录,如和(B’Chir et al.,2013)。本研究发现APP/PS1小鼠海马组织PERK/eIF2α信号和表达上调,因此本研究进一步检测了自噬相关基因和的表达。其中,编码的蛋白质Beclin1是自噬的成核因子,调控自噬的启动。ATG7是一种泛素E1样酶,调控ATG5与ATG12的共价结合,三者主要参与自噬体的形成。本研究发现,APP/PS1转基因可以下调小鼠海马组织和的mRNA水平,上调的mRNA水平,说明APP/PS1转基因可能影响了自噬的启动和自噬体的形成。与本研究一致,Panagaki等(2018)发现,APP/PS1小鼠海马 Beclin1和ATG7表达下调;
Mohammadi等(2016)在Aβ诱导的AD大鼠海马中发现ATG12的表达升高。和是PERK/eIF2α信号的下游靶分子,本研究发现,伴随着PERK/eIF2α激活,APP/PS1小鼠海马中只有表达上调。因此,表达升高可能是AD病理状态下UPR过度激活的结果。而本研究发现,跑台运动下调APP/PS1小鼠海马PERK/eIF2α信号的同时,却上调了的表达。造成这一结果的原因可能是,跑台运动增强了APP/PS1小鼠海马的自噬活性,提高了自噬效率,因而出现的代偿性升高。为了验证这一假设,本研究进一步检测了自噬效率的变化。结果发现,APP/PS1小鼠海马LC3Ⅱ的蛋白水平升高,P62的蛋白水平降低。值得注意的是,以往研究发现,PERK诱导的eIF2α磷酸化可以导致 ATG12 依赖的 LC3I向 LC3II的转化(Kouroku et al.,2007)。而本研究发现,伴随着PERK/eIF2α信号的激活,APP/PS1小鼠海马LC3Ⅱ表达升高,P62表达下调,说明PERK/eIF2α虽然激活了自噬,但自噬的效率并未提高。这些结果支持了Cai等(2016b)的观点,即AD脑内可能存在过度激活的UPR和无效的细胞自噬。近期研究发现,采用药理学手段下调APP/PS1小鼠皮质UPR后,自噬效率增加(Guo et al.,2018)。药理性下调ERS可以逆转APP/PS1小鼠脑内自噬相关蛋白的表达抑制,进而减少Aβ负荷(Panagaki et al.,2018)。这提示,靶向调节ERS和细胞自噬途径可能有助于缓解Aβ病理。关于运动的研究表明,跑台运动可以提高APP/PS1小鼠海马细胞自噬活性,并降低Aβ水平(Zhao et al.,2018)。本研究发现,跑台运动下调了APP/PS1小鼠海马P62的蛋白水平,说明跑台运动提高了小鼠海马细胞自噬活性。而伴随着细胞自噬活性的提高,跑台运动还下调了PERK/eIF2α信号。这提示,ERS-细胞自噬途径可能参与了AD的运动干预机制。
综上,APP/PS1转基因诱导小鼠海马PERK/eIF2α过度激活,自噬相关基因表达异常,自噬效率降低;
而跑台运动可以下调APP/PS1小鼠海马PERK/eIF2α信号,并提高自噬活性,证实了AD海马内存在ERS-细胞自噬途径异常,而运动可改善AD海马ERS-细胞自噬途径的异常。
3.3 跑台运动上调APP/PS1小鼠海马CRT介导的ERS-细胞自噬偶联
以往研究发现,ERS诱导剂可以激活细胞自噬,错误折叠蛋白质聚集可通过PERK/eIF2α通路诱导细胞自噬,内质网Ca失衡也参与诱导细胞自噬(Fedeli et al.,2019;
Ogata et al.,2006)。然而,ERS究竟是如何偶联细胞自噬目前尚不完全清楚。本研究发现,在APP/PS1小鼠海马组织中,UPR激活后细胞自噬虽然被启动,但自噬效率并未提高;
并且,运动虽然抑制了APP/PS1小鼠海马UPR,但提高了自噬活性。这说明,在AD病理状态下,ERS与细胞自噬之间存在复杂的调控关系。最近研究显示,内质网定位的CRT可偶联ERS和细胞自噬,在ERS状态下,CRT受UPR的诱导表达上调,高表达的CRT通过与LC3结合诱导细胞自噬,从而降解累积的异常折叠蛋白(Yang et al.,2019)。这提示,激活CRT介导的ERS-细胞自噬偶联可能具有缓解AD脑内蛋白质稳态失衡的潜力。
通过生物信息学分析发现,CRT蛋白序列的结合域(Pfam)存在LC3结合区,说明CRT具有介导细胞自噬的潜在可能。基于该生物信息学预测,本研究首先采用Realtime PCR和Simple western技术检测了小鼠海马CRT的表达。结果显示,APP/PS1小鼠海马的mRNA水平和蛋白水平均出现下调,而运动可以上调APP/PS1小鼠海马CRT的蛋白水平。随后,本研究采用免疫荧光技术,检测了CRT与LC3的共定位情况和表达水平,结果发现,APP/PS1转基因并未影响小鼠海马CRT/LC3共定位水平,跑台运动也未引起APP/PS1小鼠海马CRT/LC3共定位水平的变化。但在分子表达水平上,APP/PS1小鼠海马中伴随着LC3表达上调,CRT表达出现下调。运动虽没有影响APP/PS1小鼠海马LC3的表达,但上调了CRT的表达。因此,本研究推测,在PERK/eIF2α过度激活状态下,APP/PS1小鼠海马自噬活性降低可能与CRT的表达下调有关。而在运动干预下,APP/PS1小鼠海马自噬活性增加可能与CRT的水平上调有关。支持这一推测的证据如下:1)生物信息学预测,CRT可能介导细胞自噬;
2)Yang等(2019)通过免疫共沉淀实验确定了CRT与LC3相互作用的位点,并在诱导ERS的条件下发现CRT与LC3的相互作用增强,在Yang等(2019)的研究中,过表达CRT可促进使细胞自噬水平并缓解ERS,而敲减CRT则导致ERS条件下自噬受损;
3)AD患者脑内存在自噬异常也存在CRT表达下调(Hubbard et al.,2022;
Taguchi et al.,2000),而本研究发现运动可以上调CRT的表达并提高自噬活性。综上,CRT可能是运动提高细胞自噬的效应因子,其可能通过介导ERS-细胞自噬偶联,促进AD脑内错误折叠蛋白质清除。
和突变可能破环内质网功能,增加APP错误折叠和Aβ聚集,诱发ERS并导致PERK/eIF2α过度激活,从而降低自噬效率,抑制AD脑内异常蛋白质的清除。跑台运动可以预防和基因突变导致的AD病理,其生物学机制可能与ERS-细胞自噬偶联有关(图6),即跑台运动可以降低Aβ斑块水平,减少APP在内质网中积累,缓解ERS并抑制PERK/eIF2α过度激活,进而提高细胞自噬活性并上调CRT介导的ERS-细胞自噬偶联,从而有益于减少AD脑内错误折叠蛋白质的生成和聚集。

图6 运动调控ERS-细胞自噬偶联缓解AD病理的可能机制Figure 6.Possible Mechanism of Exercise Alleviating AD Pathology by Regulating ERS-autophagy Coupling
猜你喜欢 海马荧光小鼠 海马作文周刊·小学二年级版(2022年20期)2022-05-05小鼠大脑中的“冬眠开关”学苑创造·A版(2020年9期)2020-10-13肠道细菌改变小鼠更难克服恐惧大自然探索(2020年2期)2020-04-30魔力荧光色小资CHIC!ELEGANCE(2018年28期)2018-09-14玛卡荧光碳点的合成及用于苦味酸的荧光检测分析化学(2016年12期)2017-02-04Fluorescence world荧光人间小资CHIC!ELEGANCE(2016年15期)2016-07-26萌萌哒之长满痘痘的豆丁海马科技知识动漫(2016年6期)2016-06-24最佳操控奖 海马3运动版汽车观察(2009年1期)2009-02-18宠物小鼠金山(2009年11期)2009-01-05








