三硝基苯磺酸诱导急性肠纤维化大鼠模型的改良方法
时间:2023-02-12 14:25:06 来源:柠檬阅读网 本文已影响 人 
王怡如, 蒋笑影, 董若曦, 潘一滨, 韩向晖, 曹永清
(1. 上海中医药大学附属龙华医院肛肠科, 上海 200032; 2. 上海中医药大学附属龙华医院中医外科研究所, 上海 200032)
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎,其特征是在遗传易感个体的消化道中存在长期持续的炎症。肠纤维化是CD病程中的常见并发症,表现为肠腔狭窄和肠壁增厚,在上下消化道均可发生,以回肠末端、回盲瓣、肛直肠段多见;
半数CD患者存在发生肠腔狭窄的终身风险,纤维化使器官失去正常结构及功能,严重的狭窄是导致手术和肠切除的主要原因之一[1-2]。既往认为,CD患者的肠纤维化是一个相对缓慢的过程,故肠纤维化动物模型多以周期性反复引发炎症建立的慢性纤维化为主。但近期研究显示,纤维化病变在部分CD患者中迅速发展,形成狭窄的速度可能比以往认为的早得多[3]。因此,对CD患者急性肠纤维化的研究已成为该领域的重点之一,建立符合CD患者肠纤维化疾病特征的动物模型是研究该疾病发生机制和治疗方法的主要途径和重要需求。
半抗原化剂2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)灌肠诱导的结肠炎模型是研究CD 最常用和最具特征性的模型之一[4],但其诱导的急性肠纤维化模型目前在国内未见探讨。基于这一广泛验证的模型基础,本课题探索了一次性保留灌肠建立急性肠纤维化大鼠模型的改良方法,同时设立多组不同药物剂量和乙醇溶液浓度的配比以观察诱导的大鼠结肠炎症和纤维化效果差异。
1.1 实验动物
SPF 级雌性SD 大鼠30 只,体质量为200~220 g,购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001],质量合格证为20210107Aazz061900 882。大鼠饲养于上海中医药大学动物实验中心[SYXK (沪) 2020-0009],饲养环境温度为(23±2)℃,相对湿度为40%~60%,光/暗每12 h交替,灭菌全价营养饲料喂养,自由进食饮水。本研究方案经上海中医药大学动物实验伦理委员会批准(PZSHUTCM201225008),实验过程符合3R原则。
1.2 主要试剂与仪器
TNBS(批号SLCG2384)和戊巴比妥钠(批号57-33-0) 均购自美国Sigma 公司;
无水乙醇(批号20191017)、苯胺蓝(批号20190604)、磷钼酸(批号20190626)和正丁醇(批号20190802)均购自国药集团化学试剂有限公司(沪试);
双蒸水和生理盐水(即0.9%氯化钠溶液)(批号S2005066)购自上海百特医疗用品有限公司;
多聚甲醛(批号202201)购自武汉赛维尔生物科技有限公司;
伊红(批号C201103)、苏木精(批号C201204)和BASO粪便隐血双联法试剂组(批号BA-2020E)购自珠海贝索生物技术有限公司;
Weigert铁苏木素(批号20200407)购自北京索莱宝科技有限公司;
二甲苯(批号2021033102)购自上海盛稀化工有限公司。
手术器械购自上海医疗器械(集团)有限公司手术器械厂(金钟手术器械);
一次性无菌注射器购自威海洁瑞医用制品有限公司;
L80 型一次性直肠给药管购自任丘市洪达气体有限公司(绿林);
组织包埋机和石蜡切片机为德国Leica公司产品;
光学显微镜为日本Olympus公司产品。
1.3 药品配制及动物分组
将无水乙醇与双蒸水按相应体积比配制成体积分数为50%和75%的乙醇溶液。5%TNBS 分别与不同体积分数的乙醇混合配制成体积比为1∶1 的5%TNBS+50%乙醇溶液(A 组)、体积比为1∶1 的5%TNBS+75%乙醇溶液(B 组)、体积比为1∶1 的5%TNBS+无水乙醇溶液(C 组),以及体积比为2∶1 的5%TNBS+50%乙醇溶液(D组)。4个不同配比的TNBS/乙醇溶液配制后,在4 ℃冷藏避光保存,使用前再次混匀。
30 只雌性SD 大鼠随机分为5 组,每组6 只。对照组予生理盐水0.6 mL 灌肠,模型组分为A、B、C、D组,用上述对应配比的溶液各0.6 mL灌肠。
1.4 一次性保留灌肠法建立炎性肠纤维化大鼠模型
各组大鼠适应性饲养1 周,第7 天起禁食不禁水24 h,第8 天造模前称重。造模麻醉前再次促进大鼠排便。造模时,先用2%戊巴比妥钠溶液按每只大鼠0.3~0.4 mL 的用药量进行腹腔注射麻醉。麻醉起效后参考Morris法[5]进行一次性灌肠操作,改良方法:用1 mL 注射器连接圆头灌肠软管(长8 cm,内径2 mm)制作灌肠器;
麻醉后的大鼠以俯卧位提起大鼠尾部,暴露肛门,灌肠管蘸取少许造模药液润滑管壁,插入肛门约8 cm 处,缓慢匀速推注药液0.6 mL;
退出灌肠管后立即用木夹子夹闭大鼠肛门,并将大鼠呈头低位尾部固定于笼网;
保持肛门夹闭状态,计时30 min 后取下夹子将大鼠放回笼中,待其自然苏醒(图1)。

图1 大鼠保留灌肠示意图Figure 1 Schematic diagram of retention enema
1.5 造模后动物一般情况观察
记录造模后7 d内大鼠每日精神及活动状态、体质量变化、粪便性状及便血、死亡情况,并参照Murano等[6]方法进行大鼠疾病活动指数(disease activity index,DAI)评分。(1)体质量下降:无,记0 分;
1%~5%,记1 分;
6%~10%,记2 分;
11%~15%,记3 分;
>15%,记4 分。(2)粪便性状:正常,记0分;
松散,记2 分;
稀便,记4 分。(3)便血:隐血(-),记0分;
隐血(+),记2分;
肉眼血便,记4分。DAI=(体质量下降分数+粪便性状分数+便血分数)/3,以造模当日体质量作为初始体质量,与造模后第1 天起每日体质量作对比。
1.6 造模后实验动物取材与样本保存
造模后第7天、第14天,用2%戊巴比妥钠溶液按每只大鼠0.7~0.8 mL的用药量腹腔注射麻醉每组一半大鼠。麻醉前不禁食不禁水。麻醉起效后,沿腹中线剖开腹腔并观察腹腔内情况;
经腹主动脉采血后,以脱颈椎法安乐死大鼠;
然后取下肛门至盲肠全段,于造模给药处(距肛门6~10 cm 范围)剪断肠管;
沿肠管纵轴剖开,必要时用生理盐水冲洗肠腔残留粪便,观察肠道炎症最明显处;
测量后截取该部位结肠组织,固定于多聚甲醛溶液中,留做病理切片。若全结肠未见明显肉眼下大体形态改变,则截取距肛门1 cm、3 cm、6 cm、9 cm范围内的结肠肠段0.3 cm作为样本。
1.7 结肠组织大体形态学观察
取材时记录腹腔积液、病变肠管与周围组织关系等,无张力拉直肠管后测量从肛门到结肠盲肠交界处的全结直肠长度。然后观察肠管外壁有无穿孔、狭窄、膨大、粘连等改变,沿纵轴剖开肠管后观察肠腔面。综合以上信息,参考Butzner 等[7]方法进行大鼠结肠炎大体损伤指数(colon macroscopic damage index,CMDI)评分。(1)结肠损伤:正常外观,记0 分;
局灶充血但黏膜无糜烂或溃疡,记1 分;
溃疡不伴充血或肠壁增厚,记2分;
一处溃疡伴炎症,记3分;
两处及以上的局灶溃疡或炎症,记4 分;
主要炎症损伤处沿肠管纵向延伸范围>1 cm,记5 分;
损伤范围>2 cm,每增加1 cm 再多记1 分,即记6~10 分。(2)结肠与周围组织关系:与周围组织无粘连,记0 分;
轻度粘连(与周围组织易于分离),记1分;
重度粘连(与周围组织不易分离),记2 分。评分由两位研究者分别独立进行,再对结果进行比较分析。
1.8 HE染色和Masson染色
各组炎症结肠组织以多聚甲醛溶液固定后,经常规石蜡包埋、切片、脱水等步骤制作病理切片,同一块结肠组织分别切片进行HE 染色和Masson 染色,光学显微镜下取肠壁全层视野,观察黏膜损伤程度、肠壁增厚、炎细胞浸润深度、纤维化部位等情况,并比较对照组与模型组的胶原蛋白沉积部位和范围。
1.9 统计学方法
应用SPSS 23.0 软件进行统计学分析,并用Graphpad Prism 8.0 软件作图。计数资料以率描述,计量资料以±s描述。资料服从正态分布时,两组间比较采用独立样本t检验;
多组间比较采用单因素方差分析,并以LSD-t检验进行两两比较。若资料不服从正态分布,则多组间比较采用Kruskal-Wallis 非参数检验,以Dunn 法作进一步比较。以P<0.05 表示差异有统计学意义。
2.1 造模后大鼠一般情况
造模后,模型组大鼠出现不同程度的精神萎靡,表现为反应慢、挣扎减弱、喜聚集、蜷缩、鼠毛暗淡,且肛周有稀便污染;
持续1~3 d 后,整体情况随体质量升高逐渐好转。适应期及造模当日,各组大鼠体质量比较差异无统计学意义(P>0.05);
造模前禁食24 h 后,大鼠体质量较前平均下降(18.3±8.7)g。造模完成后,对照组在进食后体质量迅速回升,模型组体质量持续下降1~2 d 后才开始缓慢回升。与对照组相比,模型组造模后第1、2天的体质量明显偏低,差异具有统计学意义(P<0.05或P<0.01,图2A)。
造模24 h 后,模型组均可见粪便性状改变,便质稀或呈糊状,伴黏液及血迹。肉眼见血便多数持续2~3 d;
隐血阳性在肉眼血便消失后仍存在1~3 d;
稀便持续时间每组不等,A 组3~6 d,B 组3~7 d,C组4~7 d,D组模型不稳定,持续1~14 d。造模后24 h各模型组的DAI 评分均较对照组明显升高,其中B 组与对照组相比差异有统计学意义(P<0.05,图2B);
造模后24 h 各模型组的DAI 评分均逐渐下降,但各模型组之间DAI 评分比较的差异无统计学意义(P>0.05,图2B)。

图2 造模后大鼠体质量变化趋势(A)和疾病活动指数评分(B)Figure 2 Changes in rat body mass(A)and disease activity index(B)after model establishment
2.2 模型动物死亡率
A 组与B 组观察期内大鼠无死亡。C 组造模后第2天和第6 天各有1 只大鼠死亡,D 组造模后第3 天有2只大鼠死亡,C组与D组死亡率均为33.3%。
2.3 结肠大体外观
对照组结肠正常,肠管外壁与周围组织易于分离。模型组各组大鼠可见不同程度的结肠炎改变,造模给药处可见局部肠管膨隆,肠段增厚明显,肠管质韧,肠管外壁均未见穿孔,造模部位肠管外壁与周围器官组织炎性粘连,严重病变肠管外出现脂肪组织蓄积、包裹,不易分离。模型组之间对比,A 组的结肠外观变化总体较轻;
B、C组节段性增厚较明显,可伴上段肠管扩张,出现不完全性肠梗阻;
D 组内模型差异较大,部分出现明显的炎性狭窄性病变,部分未见明显异常(图3)。

图3 模型建立后的大鼠结肠组织Figure 3 Colonic tissue of rats after model establishment
2.4 结肠长度及形态学改变
对各组大鼠结肠长度进行测量,结果见图4A。对照组大鼠结肠长度为16~18 cm,各模型组结肠长度总体均较对照组缩短,其中A、B、C 三组与对照组相比差异具有统计学意义(P<0.05),D组结肠长度变化与对照组相比无明显差异,A、B、C 三组间对比的差异无统计学意义(P>0.05)。
纵向剖开肠管观察肠管内壁,第7 天时模型组见造模部位肠壁出现严重炎性损伤,坏死组织色黑,附着于肠腔内表面,与周围组织分界明显;
第14 天时局部肠段仍有增厚,坏死组织较前部分脱落,黏膜见一处或多处纵深溃疡,结肠皱襞紊乱或消失,非药物作用部位的黏膜肉眼观大致正常。模型组之间比较,第7 天时,B 组和C 组造模效果相近,肠壁损伤及肠壁增厚明显,病变范围大;
A 组炎症范围及程度较轻;
D 组大鼠结肠肉眼未见明显损伤。第14 天时,B组和C 组造模部位肠壁增厚仍较明显;
A 组也可见肠壁裂隙样溃疡,肠壁增厚程度较前两组轻;
D 组肠壁见较大范围凹陷的溃疡面,但肠壁增厚程度轻于B 组和C组。
对各组结肠炎大体损伤程度进行评分,结果见图4B。模型组CMDI评分均较对照组升高,其中A组炎症范围、肠壁增厚程度总体较轻,D 组内大鼠病变程度差异较大,A、D 两组与对照组相比的CMDI 评分差异无统计学意义(P>0.05);
B组、C组造模处组织损伤及纤维化明显,与对照组的CMDI评分差异具有统计学意义(P<0.05,P<0.01)。
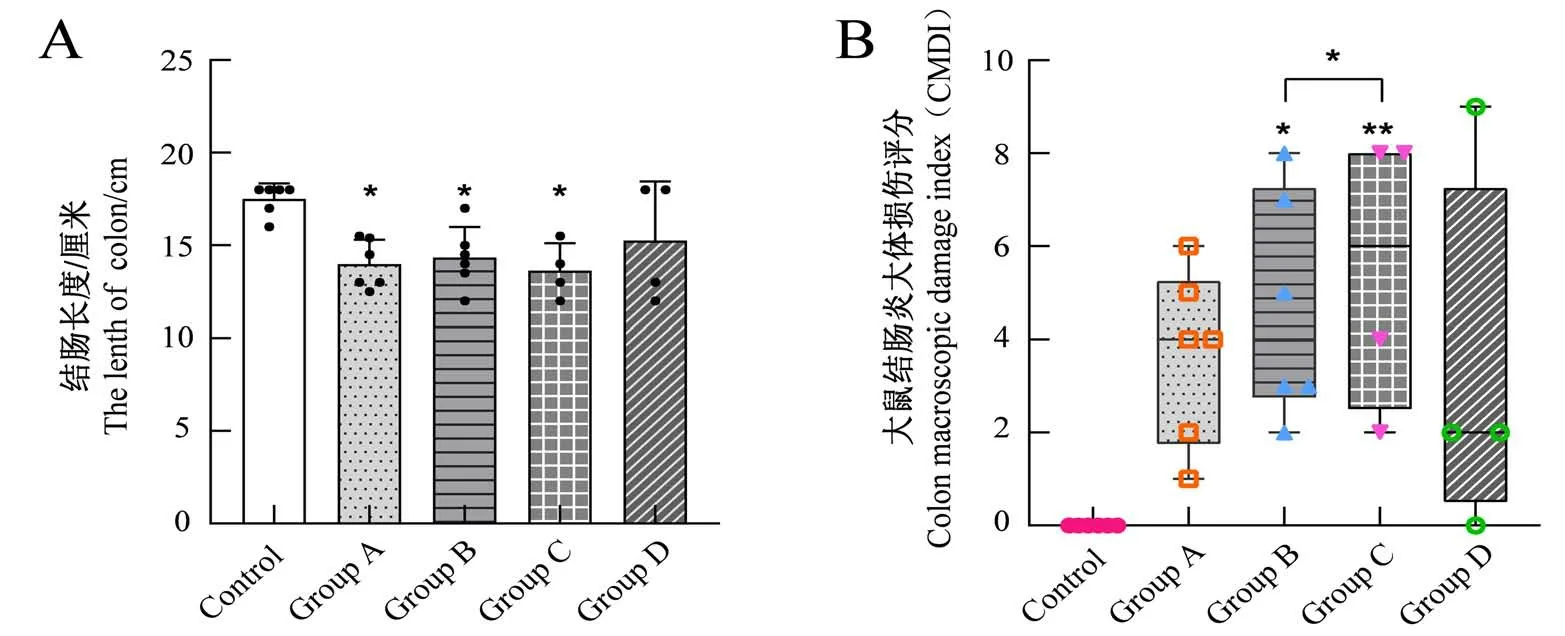
图4 造模后大鼠结肠长度(A)和结肠炎大体损伤评分(B)Figure 4 The length of rat colon after model establishment(A)and colon macroscopic damage index(B) in rats after model establishment
2.5 结肠组织病理学改变
2.5.1 HE染色
光学显微镜下表现为造模部位黏膜裂隙样溃疡、缺损、坏死或脱落,隐窝表现为异常缩小、扩大或分支;
炎细胞浸润达肠壁深层,黏膜下层和浆膜层亦可见炎细胞浸润。与正常对照组相比,模型组肠壁有不同程度增厚,以黏膜下层增厚明显,黏膜肌层和固有肌层也可见增厚,部分切片可见管壁组织变性的血管。总体而言,A组炎症程度较轻,B组和C组较重,D组炎症程度轻重不一(图5A)。
2.5.2 Masson染色
Masson 染色使胶原纤维及黏液蓝染,细胞质和肌纤维红染,细胞核呈棕黑色。对照组与模型组对比明显。对照组蓝染区域主要集中在黏膜下层,黏膜下层为疏松结缔组织,生理状态下胶原纤维含量丰富,肌层及浆膜层组织内无明显蓝染。模型组以黏膜下层、肌层弥漫性蓝染和厚度增加最为明显,部分样本浆膜层亦出现类似表现。炎细胞浸润和胶原沉积呈透壁性,深达肠壁各层。第7天时,A组、B组和C组黏膜下层、肌层及浆膜层增厚,组织内均出现弥漫性蓝染的胶原沉积,其中A、B两组黏膜下纤维化最为明显;
C组浆膜层也出现明显增厚及胶原沉积;
D 组与对照组无明显差异。第14 天时,A 组标本造模部位的黏膜下层和肌层均出现胶原弥漫性沉积增多;
B组和C组病变分别与其第7天样本相似;
D组肠壁增厚,浆膜层胶原弥漫性沉积增多,肌层纤维化严重,组织间分界模糊(图5B)。
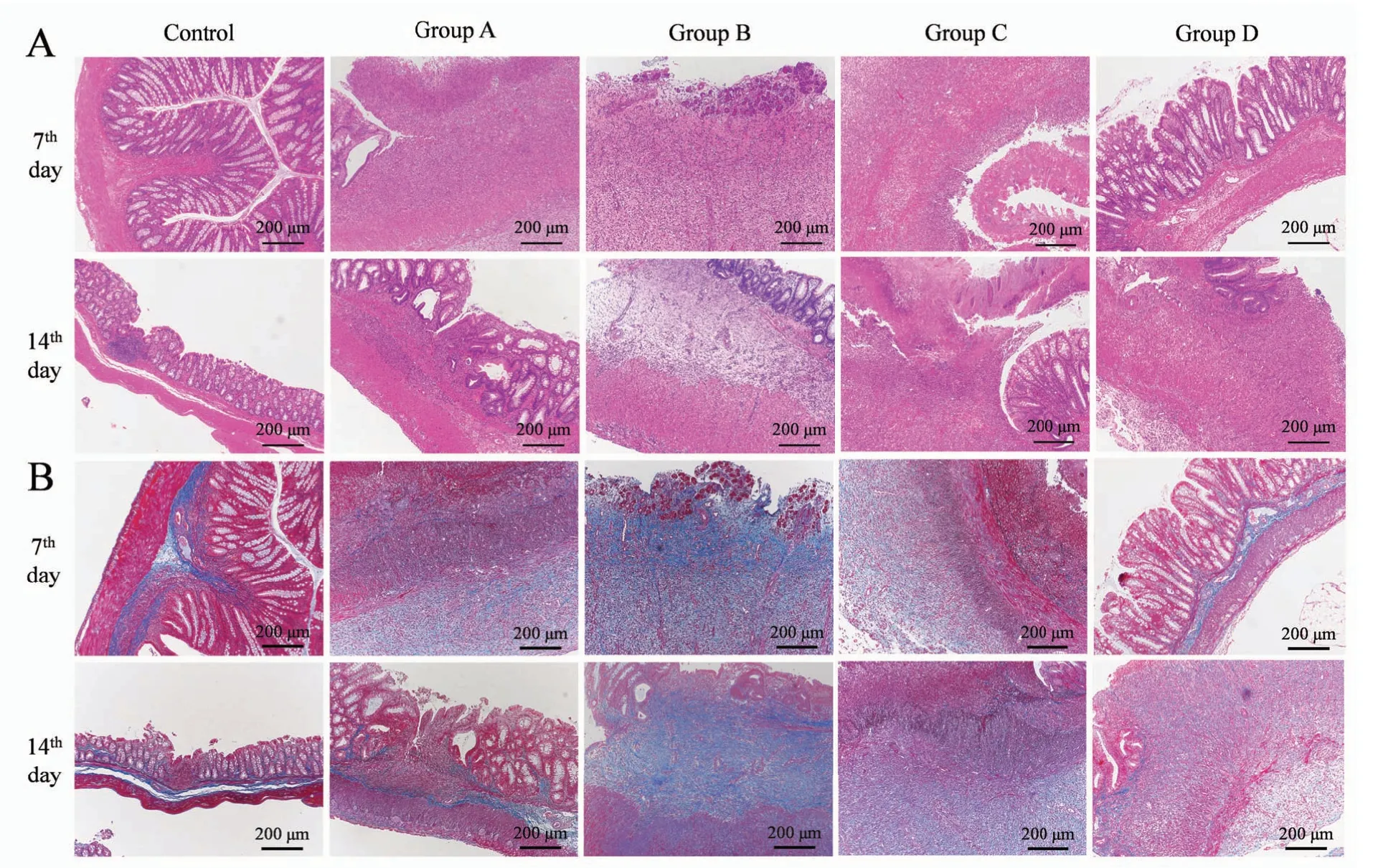
图5 造模后大鼠结肠HE(A)和Masson(B)染色结果(×100)Figure 5 HE staining(A)and Masson staining(B)of rats’colons after model establishment(×100)
由于肠纤维化在CD发展过程中难以预测,仅靠临床人体研究进展困难或滞后,动物模型可以极大地补充和扩展肠纤维化在CD中的研究,具有无可替代的重要作用。肠纤维化模型有限,现已开发出化学诱导型、微生物型、免疫介导型、基因靶向型、自发型、辐射诱导型和手术干预型等七大类[8-9]。不同类型的疾病模型没有绝对的优劣和固定标准,它们具有不同的关键特征、潜在机制和优缺点,允许人们从多个侧面增进对疾病机制的认识并加以互补,研究人员可根据模型特点,按照病因学、免疫学、发病机制、药物筛选等不同研究方向和用途选用恰当的模型[10-11]。
CD 的炎症及纤维化均涉及先天和后天性免疫机制[2]。尽管目前CD 的炎症治疗已取得显著进展,但抗感染治疗不能减少纤维化,也尚无抗纤维化药物可用[8,12]。在应用广泛的化学诱导型模型中,TNBS因其诱导的结肠炎症与CD 疾病特征和免疫机制具有相似性,故在CD 的免疫研究和药物筛选上占据重要地位[13]。TNBS是一种接触性致敏的化学性半抗原物质,与乙醇配制成溶液后使用,由乙醇破坏肠黏膜屏障完整性,继而使TNBS得以渗入肠壁,与组织蛋白结合形成抗原后诱发免疫反应,引起结肠炎症[13]。
以往认为,CD的肠纤维化是在相对缓慢的慢性炎症过程中产生[3,12]。鉴于此,TNBS诱导的肠纤维化模型多为慢性模型,通过周期性重复给药方案来建立,需在6~8周甚至更长的周期内定期反复给药[8,14],故成模周期长、效率低、鼠龄老化严重、动物死亡或产生耐受等不足限制了其应用。同时,近期研究显示,CD的肠纤维化进程既不完全依赖于炎症,也不一定是一个缓慢的过程[3],CD肠纤维化和狭窄可以在短期内发生,所以急性形成的肠纤维化动物模型对病程研究也具有重要意义。本研究证实TNBS一次性造模即可导致急性肠纤维化发生,打破了TNBS难以在短期内诱导肠纤维化的以往观点[9]。
以往文献中有关TNBS诱导造模的操作方法通常是向大鼠或小鼠结肠内滴注一定配比的TNBS溶液并采用倒置体位保持1~3 min。但在实践中这种方法失误可能性较大。本课题组反复摸索实验条件,认为成模的关键在于TNBS 溶液与肠壁有效接触且作用时间充足,才能在特定的药物配比下产生预期的效果。故本研究中采用了改良的一次性保留灌肠法,通过延长药物的有效作用时间,不仅成功建立了纤维化明显、成模率稳定的急性纤维化模型,还提高了造模效率。
本研究还通过设立不同药物配比的分组来观察模型效果的差异。尝试不同TNBS 溶液配比的必要性在于,TNBS的有效剂量接近动物的致死量,需要给予亚致死量的TNBS 来使结肠炎症最大化[10,15]。造模条件不足,则出现成模率低、炎症轻、自愈快、同一造模条件下组内模型间异质性大等问题;
造模条件过度,则导致动物极度虚弱或死亡率升高。本实验中4 个模型组给药体积相同,A、B、C 组按照TNBS/乙醇为1∶1的比例使用了相同剂量的TNBS和50%、75%和100%的乙醇溶液来配制;
结果显示A、B 两组无动物死亡,A 组总体纤维化评价较B 组轻,B、C 两组均产生了中重度的肠纤维化,但C组有33.3%的死亡率。D组按照TNBS/乙醇为2∶1 的比例,使用了2 倍剂量的TNBS 和50%的乙醇溶液;
结果显示组内成模效果差异较大,且同样有33.3%的死亡率。以上结果说明高剂量的TNBS和高浓度的乙醇均具有较强的致死性,而乙醇浓度过低会使破坏黏膜屏障的效果降低,导致模型不稳定,而A、B两组的配比在保留灌肠中使用相对安全有效。对于实际使用而言,虽然A、B两组纤维化程度有轻重差异,但均具有应用价值:A 组造模条件适用于针对CD疾病早期、纤维化总体较轻的研究,B组适合于CD纤维化明显的疾病中晚期研究。
纤维化的特征是富含胶原的细胞外基质,在通常含有较少结缔组织的组织中过度蓄积[3]。富含胶原的细胞外基质及间质样细胞在正常肠组织中主要存在于黏膜下层,二者在病变局部增生不仅导致黏膜下层过度纤维化,还导致黏膜肌层及固有肌层增厚,这被认为是CD 肠纤维化的组织学特征[16]。在本组模型中,造模部位出现肉眼可见的病变,肠段的肠壁增厚;
HE染色显示炎细胞呈弥漫性浸润于肠壁的各层结构中;
Masson 染色显示,TNBS/乙醇诱导的肠纤维化模型的纤维化和增厚主要发生在黏膜下层和肌层,浆膜层亦可有明显的胶原纤维弥漫性增多。Zidar 等[17]在人类CD 样本上观察到的结果与上述结果一致;
该学者认为,CD的纤维化发病机制可能与其他器官的纤维化相当,可能是肠壁对其深层结构中存在的炎症产生(过度)反应的结果,纤维化的部位即是间充质细胞聚集的部位。本模型模拟了CD“透壁性”炎症和深层组织纤维化的表征,在组织病理学水平上具有应用于CD纤维化研究的参考价值。
使用TNBS 也存在一定不足,这是由于TNBS 诱导模型受多方面因素的影响。(1)动物对药物反应的异质性:TNBS 能否诱发结肠炎首先与动物有关。TNBS可用于大鼠、小鼠和兔,不同种属和品种品系的动物具有不同的易感性和耐药性,病程进展和持续时间也有差异,选择对TNBS敏感的品种品系能增加模型的成功率。常见的IBD 模型动物有SD、Wistar 大鼠和BALB/c、SJL/J、WT、C57BL/6J 小鼠[18]。需要注意的是,某些动物(如C57BL/6 小鼠)对肠道瘢痕形成抵抗力较强,可诱发炎症但不一定能引起实质性纤维化[4,7]。(2)微生物背景:微生物在肠道炎症模型建立和最终发生纤维化中发挥关键作用[3,19],诱导和维持肠道炎症依赖肠道菌群的存在,“无菌无结肠炎”的观点现已被广泛接受[11]。动物携带的微生物不同,可能使同样的浓度方案出现不同轻重的炎症。预实验有益于个体化调整浓度和剂量方案。以上为动物实验中不可避免的差异。(3)鼠龄:鼠龄小对TNBS敏感性较高,但由于鼠龄与体质量正相关,体质量过轻的动物对药物耐受性较差,容易死亡。禁食24 h 的大鼠体质量在200 g以上时造模后存活率更高。(4)性别:动物模型会因性别不同出现差异[20],故在同一实验中,应使用同性别的动物。综上,相同品种品系、来源、批次、周龄及相同的饲养环境能较好地控制模型条件的均质性,但即使严格控制了以上所有条件,仍存在出现造模失败或动物死亡的可能性,所以适量计划额外数量的动物是有必要的。
另外,TNBS 灌肠的操作技术也可能引起造模失误,故总结下述细节以供参考。(1)麻醉前充分促排粪便。粪便会吸附药液,影响药物与肠壁接触。禁食24 h 不能使粪便排空,而延长禁食时间会使大鼠体质量和耐受性进一步下降,使死亡率升高。除用棉签刺激肛门外,也可手指沿腹中线在大鼠下腹部向肛门方向轻轻推压助排。进管时若遇阻涩感说明肠腔仍有粪便存留。(2)充分的麻醉是顺利完成保留灌肠的保障。(3)使用圆头侧开口灌肠管可避免锐器导致肠穿孔的风险。(4)避免用石蜡油润滑灌肠管,以减少石蜡油黏附于肠壁。蘸取少量灌肠药液即可润滑。(5)长时间保留灌肠时,大鼠倒置悬挂不能完全避免药液溢出。灌肠管的插入、药液的刺激性、药液体积、给药速度等因素均可引起大鼠肠道反射使药液被排出,且溢药量难以估计。退出灌肠管后立即夹闭肛门并保持头低体位可有效避免。有研究者尝试在小鼠灌肠后使用肛塞[21],但经尝试不适用于大鼠。本实验中使用木夹,夹闭力度适中,持续夹闭30 min 后未观察到对大鼠肛门造成明显损伤。(6)药物质量是关键。同批次的新鲜TNBS和无水乙醇可保证模型效果,实验中造模时间较长时需避免乙醇挥发的影响。
造模后大鼠体质量减轻、腹泻、肉眼血便及隐血便等与肠炎程度有良好的相关性,体外观测相关症状即能体现模型的严重程度和进展。造模后24 h 通过观察体征变化判断造模效果,再进行随机分组,可减少模型异质性对研究结果的影响。
综上所述,本研究建立了一种运用改良一次性保留灌肠技术建立急性肠纤维化模型的方法,该方法简便、周期短、造模效果稳定、肠壁纤维化表现明显,动物死亡率低。而且这一方法建立的大鼠模型中肠纤维化的组织学特点与临床上CD 肠纤维化具有相似性,因此本研究中的操作方法及药物配比可推广应用于该领域的相关实验研究,具有良好的参考价值。同时,模型大鼠急性肠纤维化的分子学机制值得进一步研究探讨。
[医学伦理声明Medical Ethics Statement]
本研究所涉及的所有动物实验均已通过上海中医药大学实验动物伦理委员会审查批准(PZSHUTCM201225008)。所有实验过程均遵照实验动物相关法律法规条例要求进行。
All animal experiments involved in this study have been reviewed and approved by the Experimental Animal Ethics Committee of Shanghai University of Traditional Chinese Medicine (Approval Letter No. PZSHUTCM201225008). All experimental procedures were performed in accordance with the requirements of laws and regulations related to experimental animals, including the guidelines such as
Animal Management Regulations(01/03/2017),Laboratory Animal:Guideline for Ethical Review of Animal Welfare(GB/T 35892—2018)and ARRIVE 2.0.
[作者贡献Author Contribution]
王怡如参与课题设计、实验操作、数据收集整理、统计分析、可视化处理和论文写作与修改;
蒋笑影和董若曦参与实验操作、数据收集;
潘一滨进行实验指导、统计指导、论文理论部分的关键性修改指导;
韩向晖进行实验操作指导、论文实验部分的关键性修改指导;
曹永清负责课题策划、论文修改指导及定稿。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。
猜你喜欢 肠壁造模灌肠 超声检查对新生儿坏死性小肠结肠炎手术决策的意义探讨临床小儿外科杂志(2022年4期)2022-07-16红藤汤灌肠治疗慢性盆腔炎的护理体会中国典型病例大全(2022年9期)2022-04-19开塞露联合温盐水滴注灌肠法在脑卒中便秘病人中的应用效果观察全科护理(2021年25期)2021-09-16肠壁增厚分层并定量分析对小肠坏死的诊断价值罕少疾病杂志(2021年4期)2021-07-28脾肾阳虚型骨质疏松症动物模型造模方法及模型评价世界科学技术-中医药现代化(2021年12期)2021-04-19胆囊胆固醇结石湿热证小鼠造模方法的研制与评价世界科学技术-中医药现代化(2021年12期)2021-04-19湿热证动物模型造模方法及评价研究世界科学技术-中医药现代化(2021年12期)2021-04-1916 排CT 诊断肠壁缺血性病变的诊断价值及临床作用探讨世界最新医学信息文摘(2021年16期)2021-03-28兔急性骨骼肌损伤模型的建立及分期确定山西中医药大学学报(2020年4期)2020-10-30灌肠缓解便秘是否合适?自我保健(2019年4期)2019-08-02








