巴卡亭III,对心房纤维化的作用及其机制研究
时间:2023-01-26 16:20:04 来源:柠檬阅读网 本文已影响 人 
陈 龙 ,方国建 ,唐东方 ,林 雷 ,蔡俊锋 ,周黎瑾 ,许 凌,沈 炜,刘 洋,高 文*
(1.复旦大学附属华东医院,上海 200040;2.上海交通大学医学院附属新华医院,上海 200092)
心律失常是临床最常见的心血管疾病之一.心衰发生率随年龄增长而增加,且心律失常会增加心衰患者住院率、病死率及死亡率.慢性心衰合并心律失常在临床较为常见且形式多样,其中慢性心衰合并房颤最为常见[1],其比率超过30%.两者互为因果关系,主要与其有共同的发病危险因素有关,如年龄大、肥胖、高血压、糖尿病、睡眠呼吸暂停等[2-3].两者在病理生理机制上也相互促进,例如心衰可明显增加心房纤维化、心房牵张以及氧化应激等,从而进一步促进房颤的发生发展,最终形成一个恶性循环[4-5].因此,针对心衰相关房颤发病的关键环节(如心房纤维化)寻找可能的治疗药物是目前的重点研究方向.
巴卡亭III (Baccatin III,BAC)与紫衫醇同为红豆杉的活性成分,且结构相似.其作为紫衫醇合成的前体化合物,细胞毒性只有紫杉醇的0.1%~1%,且免疫调节活性更为显著[6-7].此外,紫杉醇因其具有独特的抗癌和抗纤维化作用,已成为研究热点,而既往研究亦表明巴卡亭III 具有抗肺纤维化的作用[8].因此,本研究旨在探索巴卡亭III 在心衰诱导的心房纤维化中是否可以发挥作用及可能的作用机制,从而为寻找心衰相关房颤的有效治疗药物提供实验依据.
1.1 实验动物及试剂
野生型C57BL/6 购于上海斯莱克实验动物中心;血管紧张素II (angiotensin II,Ang-II)购于MCE公司;巴卡亭III 购于陶素公司;DMEM 高糖培养基、DMEM 低糖培养基、PBS 粉末、二型胶原酶、0.25%胰酶(含0.02%EDTA)、Hanks 缓冲溶液以及胎牛血清等购于Gibco 公司;青霉素-链霉素溶液、磷酸盐缓冲液(PBS)以及细胞冻存液购于生工生物公司;Collagen I、α-SMA、CTGF、p-Smad2、p-Smad3、Smad2/3 等抗体购于CST 公司.
1.2 方法
1.2.1 小鼠心衰模型的制作
取6~8 周龄的野生型雄性C57BL/6 小鼠,使用戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉,并通过观察肌肉抽动、夹尾等方法观察麻醉的充分性.此后将小鼠仰面固定在手术板上,用眼科剪将胸骨剪开小口,橡皮筋撑开胸骨,完全暴露手术视野.轻轻地将一根直径为27 号的结扎杆平行主动脉弓放置,然后用一根直径7-0 的丝线将主动脉和结扎杆扎紧,将结扎杆缓慢取出,造成主动脉的部分缩窄;假手术组的小鼠进行同样的手术步骤,区别为不进行主动脉收缩[9].等待小鼠苏醒,放回SPF 环境中进行饲养.心衰手术的评价标准: 术后8 周,用小动物心脏超声检测小鼠左心室射血分数(EF)来评估是否造模成功,若EF 显著低于假手术组的值,则说明造模成功.
1.2.2 小鼠心脏超声检查
小鼠心衰模型手术8 周后进行心脏超声检查(Vivid 7,GE Healthcare).首先用2%的异氟烷进行麻醉,控制心率在400~500 之间.随后进行小鼠心功能的参数采集,主要为反映左心室功能的EF 和反映左心房功能的左心房内径(LAD).
1.2.3 免疫组化和免疫荧光
将临床样本的心房组织或小鼠的心房组织用10%福尔马林固定24 h 后,石蜡包埋,4 μm 厚度的切片机切片.按照文献[10]的方法进行马松染色和免疫荧光染色.马松染色主要用来检测心房纤维化的程度,免疫荧光染色主要观察心房成纤维细胞转变为肌成纤维细胞的数量.
1.2.4 成年C57BL/6 小鼠心房肌细胞的分离和药物处理
主要参考了Wang等[11]分离小鼠心房成纤维细胞的方法.简言之,取6~8 周的野生C57BL/6 小鼠,行脱颈处死后,用70%酒精浸泡消毒,取下小鼠心脏左右心房.用PBS 冲洗心房3~4 次,剪碎,用含1 500 U·mL-1二型胶原酶、0.25%胰蛋白酶和15 mg·L-1牛血清白蛋白的消化液在37 ℃水浴锅消化20 min.至形成单细胞悬液,用含有10%胎牛血清的DMEN 培养基终止消化.通过直径70 μm 的细胞滤网进行过滤,离心,重悬在10%胎牛血清的DMEM 培养基中,37 ℃孵育60 min,通过差速贴壁的方法获得成纤维细胞.培养24 h 后,换成无糖培养基,根据实验目的分为对照组、单纯加Baccatin III 处理组、单纯加Ang-II 处理组以及同时加Ang-II和Baccatin III 处理组进行实验.
1.2.5 细胞迁移实验
使用胰酶将培养的心房成纤维细胞消化后,用无血清培养基以2.0×105个·mL-1的密度种植在Transwell 板中,在上层中加入含Ang-II (1 μM)的600 μL 培养基,放入孔中继续培养.第2 天,洗去未迁移到下一层的细胞,已经迁移的细胞用10%的福尔马林固定后,再用0.25%的结晶紫染色,为每个视野内的迁移细胞拍照.
1.2.6 荧光定量PCR
实时定量PCR采用TRIzol 试剂提取细胞的总RNA,Primer-Script 一步法RT-PCR 试剂盒反转录成cDNA.利用SYBR Premix Dimmer Erase试剂盒通过qRT-PCR 扩增cDNA.每个样本的基因表达用内参GAPDH 均一化.引物购自生工生物公司,见表1.以2-ΔΔCt表示目的基因mRNA 的相对表达水平.

表1 qRT-PCR 分析的基因引物序列
1.2.7 Western 印迹法
将经过处理的小鼠心房肌细胞用PBS 洗涤3次.加入强RIPA裂解液,置冰上30 min,然后转移至新的EP 管中离心10 min.取上清液,用BCA 蛋白检测试剂盒检测总蛋白,按比例加入蛋白上样缓冲液 95 ℃煮沸 10 min.取 20 μg 蛋白进行SDS-PAGE 电泳,然后将蛋白转移到PVDF 膜上.用5%的脱脂奶粉室温封闭1 h,加入一抗(1:1 000),4 ℃摇床孵育过夜,TBST 洗膜3 次后加入HRP 二抗(1:1 000)室温摇床1 h,继续TBST 洗膜3 次,用化学发光成像分析仪对条带进行分析.
1.3 统计学处理
采用SPSS 25.0 统计学软件进行数据统计分析.每一个实验重复3 次以上,计量资料以均值±标准差表示.两组之间数据比较采用独立样本t检验,多组间数据比较采用单因素方差分析,以P<0.05表示差异具有统计学意义.
2.1 心衰与房颤的相关性
为验证心衰与房颤的相关性,首先检测了窦性心律、单纯房颤病人以及同时患有心衰和房颤疾病病人的左心房组织的纤维化程度.马松染色显示单纯房颤病人心房组织纤维化区域比窦性心律病人更多(P<0.05),心衰合并房颤病人的左心房组织比单纯房颤病人纤维化区域明显增加(P<0.05).同时,在临床标本上进一步检测了与纤维化密切相关的标志物ACTA2 和CTGF的mRNA 水平的改变,也得到了一致的结果,如图1 所示,表明心衰确实可以加重左心房的纤维化水平.
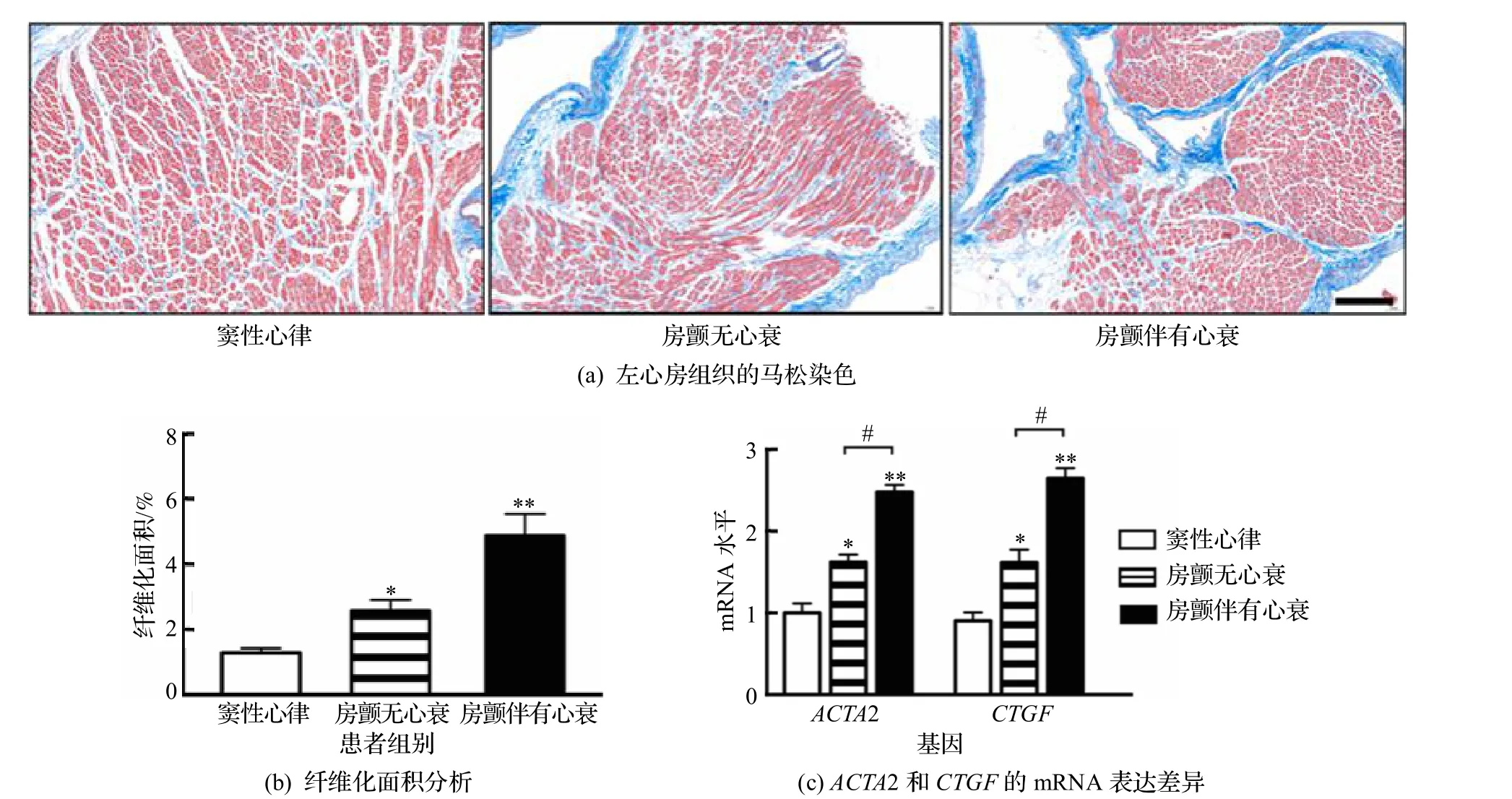
图1 左心房组织纤维化程度差异
2.2 巴卡亭III 对心房成纤维细胞的作用
为了验证巴卡亭III 是否对心衰诱导的心房纤维化有作用,首先在体外分离的心房成纤维细胞上进行了实验.细胞增殖实验表明,在给予0、5、10、20、40 μmol·L-1浓度的巴卡亭III 刺激心房成纤维细胞48 h 的情况下,细胞活性并没有受到明显的影响,说明巴卡亭III 没有明显的细胞毒性,因此选择最大浓度40 μmol·L-1进行了后续实验.细胞免疫荧光实验(图2(a)~(b))证明,使用1 μm 的Ang-II 因子刺激心房成纤维细胞48 h 可以显著增加细胞的大小和胶原纤维的形成,α-SMA标志阳性的肌成纤维细胞增多,同时给予40 μmol·L-1巴卡亭III处理的情况下,胶原纤维明显降低,α-SMA阳性的肌成纤维细胞比例明显下降(P<0.01).进一步通过细胞迁移实验(图2(c)~(d))证明,Ang-II 因子刺激48 h 后可以促进心房成纤维细胞的迁移,同时加入巴卡亭III可以降低细胞迁移的程度(P<0.01).最后还检测了纤维化相关的因子Collagen I、α-SMA以及CTGF 的蛋白水平的改变,如图2(e)~(g)所示,巴卡亭III 40 μmol·L-1处理后可以显著下调由于Ang-II 因子刺激所引起的纤维化蛋白的上调.上述实验表明,巴卡亭III 可以通过减少心房成纤维细胞的分化、迁移和纤维化蛋白的分泌来抑制Ang-II诱导的心房成纤维细胞的激活.
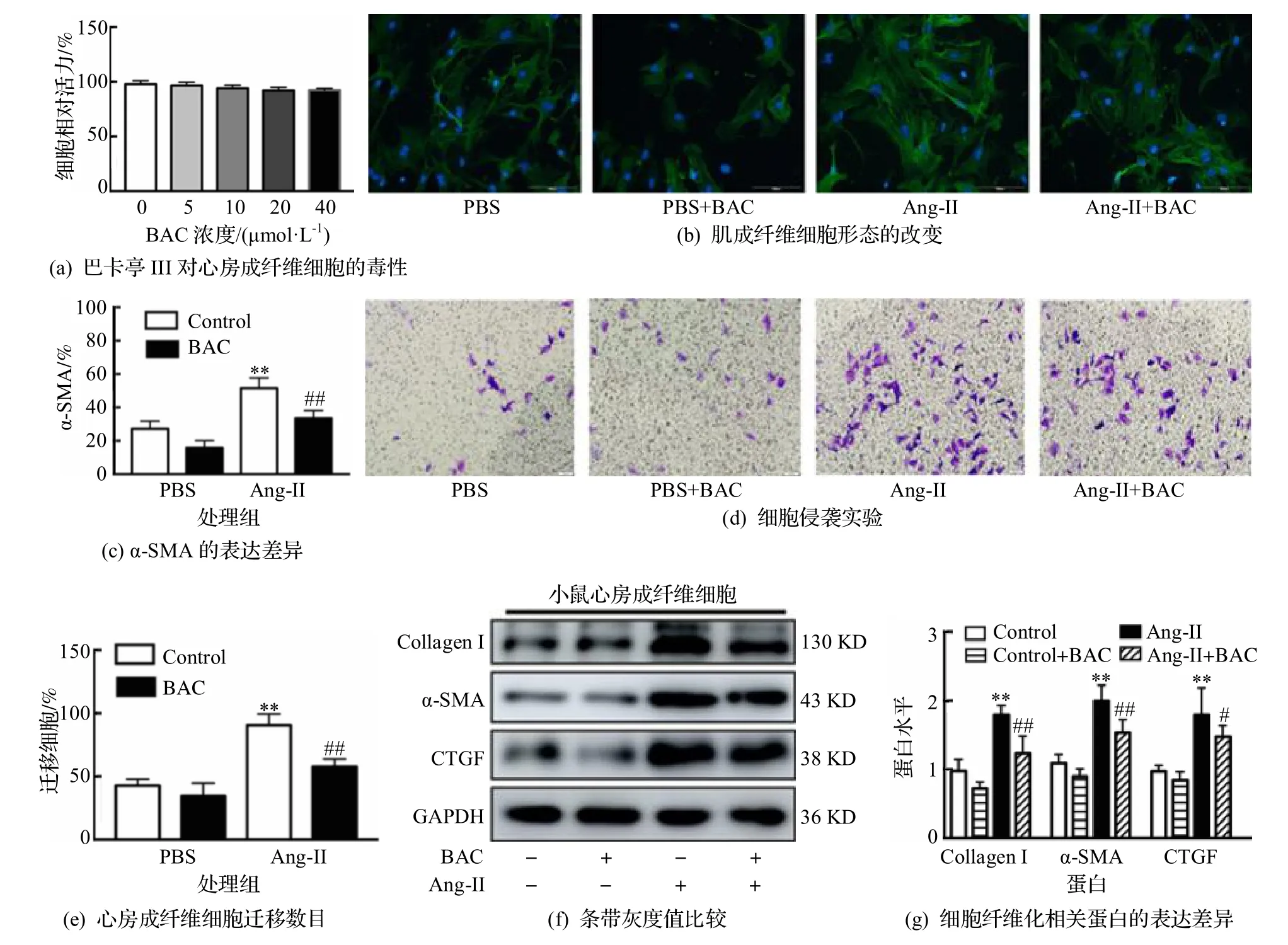
图2 巴卡亭III 在体外减轻Ang-II 诱导的心房成纤维细胞的分化、迁移和分泌细胞外基质的能力
2.3 巴卡亭III 对心房纤维化的作用
既往研究已经表明,通过小鼠主动脉弓缩窄可以造成显著的射血分数下降的心衰模型以及相应的左心房的扩大和纤维化水平升高[12-13].为了验证巴卡亭III 在体给药是否对心衰诱导的心房重构具有保护作用,参照之前的给药方法,对心衰小鼠10 mg·kg-1剂量腹腔给药[8],并观察相应指标.如图3(a)~(b)所示,心衰模型可以导致显著的射血分数下降,而同时给予巴卡亭III 的治疗组具有明显的保护效应,且差异具有统计学意义(P<0.01).通过超声心动图检查心衰诱导的左心房扩大显示,心衰模型可显著造成左心房的扩大,而巴卡亭III的治疗可以明显逆转心衰所引起的这种作用(P<0.01,图3(c)~(d)).进一步对各组小鼠左心房组织切片后行马松染色,并计算心房纤维化的面积大小,结果显示,心衰组相较于假手术组大鼠心房纤维化程度明显增加(P<0.01),而经过巴卡亭III处理后可以明显减轻心衰诱导的心房纤维化程度,表现为心房间质和血管周的纤维化程度下降(图3(e)~(f)).最后,提取各组心房组织进行Western 印迹法检测心肌纤维化标志物(图3(g)~(h)),发现与对照组相比,心衰模型可以显著增加左心房组织Collagen I、α-SMA 以及CTGF 的表达(P<0.01),而巴卡亭III 给药后,这些重要的纤维化标志物降低,具有统计学意义(P<0.01).上述结果表明,巴卡亭III 在体给药可以显著降低心衰诱导的心房重构.
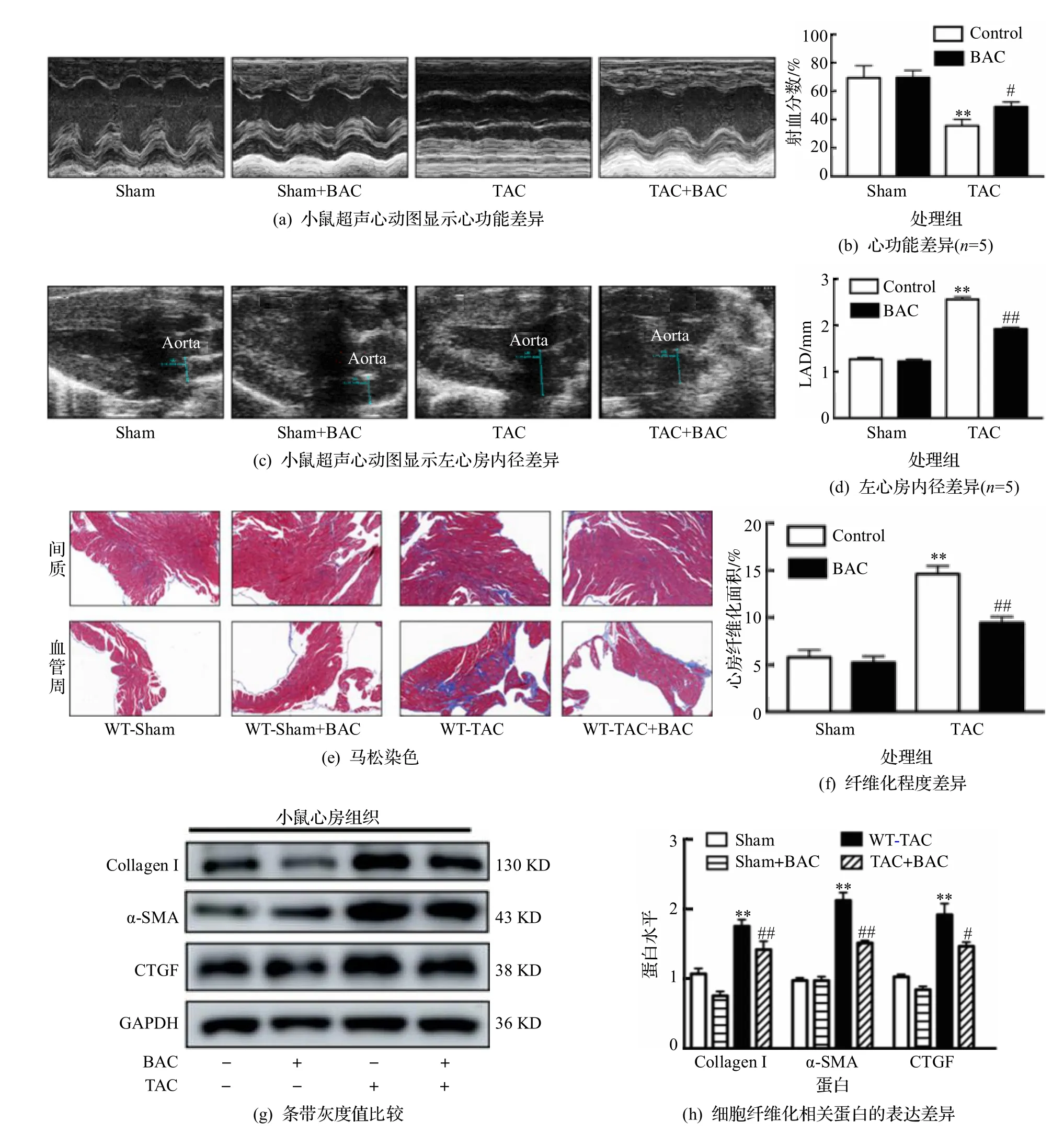
图3 巴卡亭III 在体内可以减轻心衰诱导的心功能下降,心房扩大和心房纤维化改变
2.4 巴卡亭III 对TGF-β1/Smad2/3 信号通路的作用
为了验证巴卡亭III 如何在心衰诱导的心房纤维化中发挥作用,本文关注了与纤维化发生关系密切的经典的TGF-β1/Smad2/3 信号通路[8,14-15].首先检测了Ang-II 刺激的心房成纤维细胞上该信号通路的激活,发现与给PBS 组相比,Ang-II 刺激心房成纤维细胞48 h 后可以显著上调TGF-β1、p-Smad2、p-Smad3 的表达水平,而同时给予Ang-II和巴卡亭III 后可以起到明显的保护作用,表明巴卡亭III 在细胞水平上可以抑制TGF-β1/Smad2/3信号通路的激活(图4(a)~(b)).此外,在动物水平方面,也在假手术组、假手术组+巴卡亭III 给药组、心衰手术组、心衰手术+巴卡亭III 给药组中检测了TGF-β1/Smad2/3 信号通路的表达水平,与细胞实验得到的结果相似,心衰模型可以显著激活左心房组织内TGF-β1/Smad2/3 信号通路的水平,而心衰手术+巴卡亭III 给药组可以具有明显的下调作用,两者差异具有统计学意义(P<0.01)(图4(c)~(d)).
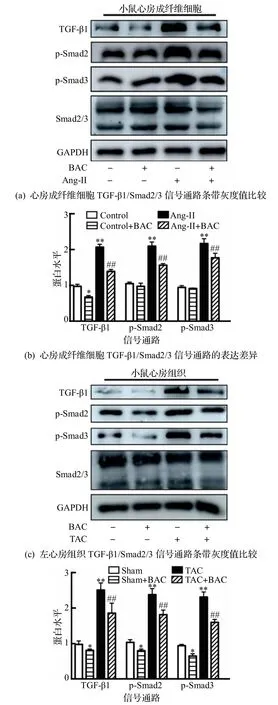
图4 巴卡亭III 通过TGF-β1/Smad2/3 信号通路发挥作用
心衰是房颤发生发展过程中最重要的独立危险因素之一,在临床上,两者总是伴随出现[16-17].心衰可以加重心房的电重构和结构重构,进而促进房颤的发生与维持;反过来,房颤也会大大提高心衰相关心血管事件的发生率和死亡率[18].在这一病理生理过程中,心房纤维化往往被认为是心衰病人发生房颤最重要的结构特征,大量研究表明心衰进展与心房纤维化密切相关.心房纤维化是炎症或其他损伤导致的纤维结缔组织对心房侵害的结果.在后负荷增加引起的心衰模型中,心肌细胞肥厚触发炎症反应,激活邻近的成纤维细胞转变为肌成纤维细胞,导致胶原蛋白性瘢痕沉积.同时,其他的病理生理状况也会诱发隐性间质和血管周胶原沉积,最终导致心房纤维化,比如高血压或主动脉瓣狭窄引起的压力超负荷以及瓣膜反流性病变引起的容量超负荷.另外,肥厚型心肌病、扩张型心肌病、代谢紊乱以及多种毒性损伤,在疾病进展到后期,也可以表现为明显的心房纤维化,同时导致心肌细胞之间电耦联及心电传导异常,引起房颤等房性心律失常[19].
抑制或逆转心房成纤维细胞的激活及其不良后果是目前临床用于治疗房颤干预措施的主要目标.但由于心房纤维化的病理机制复杂,且存在诸多危险因素及作用机制,所以目前针对心房纤维化的治疗方法匮乏且疗效甚微[20-21].Ang-II 及其受体在心肌纤维化病理进程中起重要作用,低剂量的Ang-II 可用于体外激活心房成纤维细胞[22].
本研究首先将从临床收集到的左心房样本按照是否为窦性心律,有无心衰分为: 窦性心律、单纯房颤病人、心衰伴有房颤病人三类,着重观察了纤维化相关指标,结果表明心衰伴有房颤病人的纤维化程度更加严重.体内动物实验显示,10 mg·kg-1的剂量腹腔给药处理小鼠后可显著降低胸主动脉缩窄8 周引起的心房纤维化,减轻其引起的大鼠心功能不全、左心房扩大和左心房纤维化.体外细胞实验显示,巴卡亭III 可显著抑制Ang-II 诱导的成纤维细胞分化和迁移以及分泌细胞外基质的能力,同时给予不同浓度的巴卡亭III 对细胞的活性未造成明显影响,表明它是一种安全的抑制心肌纤维化的药物[21].在研究巴卡亭III 的抗纤维化机制上,参照了既往的研究,巴卡亭III 可以通过抑制Ang-II 对经典的TGF-β1/Smad2/3 信号通路的激活作用而发挥作用,给予巴卡亭III 后可以大大减少心房成纤维细胞分泌TGF-β1,进而抑制下游Smad2/3 信号通路的激活.
综上,本研究阐述了心衰可以促进心房纤维化发生发展,巴卡亭III 作为一种新型的抗纤维化药物,可以通过经典的TGF-β1/Smad2/3 信号通路来抑制心房成纤维细胞的激活和心衰诱导的心房纤维化的进展,表明巴卡亭III 可能一种是防治心衰诱导的心房纤维化的潜在治疗药物.
猜你喜欢 巴卡纤维细胞心房 过氧化氢体外诱导小鼠胚胎成纤维细胞氧化损伤模型的构建和分析井冈山大学学报(自然科学版)(2022年1期)2022-02-28Tiger17促进口腔黏膜成纤维细胞的增殖和迁移昆明医科大学学报(2021年8期)2021-08-13心房颤动与心房代谢重构的研究进展昆明医科大学学报(2021年3期)2021-07-22滇南小耳猪胆道成纤维细胞的培养鉴定云南医药(2021年3期)2021-07-21成纤维细胞在皮肤创伤修复中的作用研究进展药学研究(2021年3期)2021-04-20正方形勇士巴卡之解救公主奇遇记数学大王·低年级(2019年5期)2019-06-13左心房戏剧之家(2018年35期)2018-02-22非洲侏儒部落里“巴卡人”中外文摘(2017年16期)2017-07-31心房青年文学家(2017年20期)2017-07-29花开在心房作文评点报·高中版(2017年9期)2017-03-27








