樟叶越桔叶2个新6−O−咖啡酰葡萄糖苷的分离鉴定
时间:2022-12-10 10:50:04 来源:柠檬阅读网 本文已影响 人 
李楚然 李 娜, 刘 云 杨晓琴 张颖君 刘惠民 赵 平,
(1. 西南林业大学西南地区林业生物质资源高效利用国家林业和草原局重点实验室,云南 昆明 650233;
2. 中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650201;
3. 西南林业大学云南森林资源培育与利用协同创新中心,云南 昆明 650233)
越桔属(Vaccinium)植物为杜鹃花科(Ericaceae)灌木,全球约有450种,据报道该属植物含有黄酮、花青素、香豆素、木脂素、环烯醚萜、甾醇、三萜等多种次生代谢产物,其中酚类物质作为主要的活性物质[1−6],具有良好的抑制肿瘤和抗糖尿病等药理活性[7−12]。樟叶越桔(Vaccinium dunalianum)作为越桔属的一种多年生常绿灌木,主要分布于我国的四川、贵州、云南和西藏等地[1]。该植物全株可药用,其叶在我国西南地区被用作治疗风湿的药物,而叶芽则作为一种民间传统茶饮,具有祛风除湿、舒筋活络的功效[1,13]。Zhao等[14]和Li等[15]发现樟叶越桔富含咖啡酰熊果苷类物质,先后从叶芽和叶中分离得到36个酚类化合物,其中包括10个新化合物樟叶越桔苷A−J(dunalianosides A−J),并发现6′−O−咖啡酰熊果苷(6′−O−caffeoylarbutin)具有良好的黑色素生成抑制活性[16],且在樟叶越桔叶芽中的含量高达31.76%[17]。此外,还通过建立樟叶越桔的多种组织培养体系,开展了不同植物生长调节剂对6′−O−咖啡酰熊果苷进行生产调控等相关研究[18−21],为樟叶越桔的后续研究工作奠定了基础。为了进一步挖掘樟叶越桔叶中的酚苷类化学成分,本研究采用硅胶、葡聚糖凝胶LH−20、Diaion HP20等多种柱层析方法,结合NMR和MS波谱分析手段,对樟叶越桔叶中的化学成分进行研究,以期为其进一步的开发利用提供参考依据。
1.1 材料
樟叶越桔叶于2015年4月采自云南省武定县,经中国科学院昆明植物研究所杨崇仁教授鉴定,植物标本(SWFU No. 1500414)存放于西南林业大学标本馆中。
甲醇(天津市大茂化学试剂厂,中国);
石油醚(云南汕滇药业有限公司,中国);
氯仿(天津市富宇精细化工有限公司,中国);
乙酸乙酯(云南汕滇药业有限公司,中国);
以上试剂均为化学纯。
Bruker DRX−400和Burker DRX−500超导核磁共振仪(Bruker公司,德国);
API QSTAR Pular−1质 谱 仪(Applied Biosystems,美 国);
Agilent G6230 TOF 质谱仪(Applied Agilent Technologies,美国);
P−1020 旋光仪(JASCO,日本);
N−1001型EYELA旋转蒸发仪(东京理化器械有限公司,日本);
电热恒温干燥箱(上海市跃进医疗器械厂,中国);
三用紫外分析仪(上海顾村电光仪器厂,中国);
SHB−Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司,中国);
BT244S型塞特路斯万分之一电子天平(北京赛多利斯仪器系统有限公司,中国);
GF254薄层层析硅胶板(青岛海浪化工厂,中国);
200~300目硅胶(青岛海洋化工厂,中国);
葡聚 糖凝胶LH−20(GE Healthcare,美 国);
Diaion HP20大 孔 吸 附 树 脂(Mitsubishi Chemical Corporation,日 本);
MCI−gel CHP20P树 脂(Mitsubishi Chemical Corporation,日本)。
1.2 实验方法
将干燥的樟叶越桔叶(6 kg)粉碎后,用80%甲醇室温浸泡提取5次,合并滤液,减压浓缩干燥后得到总浸膏。总浸膏用蒸馏水混悬后依次用石油醚和乙酸乙酯进行萃取,分别得到石油醚、乙酸乙酯和水溶液部分。取水溶液部分150 g,经Diaion HP20柱层析(60 cm×8 cm),以甲醇−水(体积比为0∶1~1∶0)溶液作为洗脱剂各1个柱体积依次进行梯度洗脱,用三角瓶每200 mL左右分别收集流出液,用氯仿∶甲醇∶水(体积比为7∶3∶0.5,6∶4∶1)展开剂对各流出液进行薄层层析后,根据样品斑点有无荧光、1% H2SO4乙醇溶液喷雾加热后的斑点显色情况及其Rf值,将相同组分的样品溶液进行合并,经旋转蒸发仪45 ℃下减压浓缩后得到5个组分(Fr. 1~Fr. 5)。
Fr. 2(54.7 g)经MCI−gel CHP20P柱 层 析(60 cm×5 cm)并以甲醇∶水(体积比为0∶1~1∶0)为洗脱剂各1个柱体积依次进行梯度洗脱后,经薄层层析检测合并后得到4个组分(Fr. 2−1~Fr. 2−4)。Fr. 2−3(16.1 g)经 Diaion HP20SS柱层析(60 cm×5 cm),以甲醇∶水(体积比为0∶1~1∶0)为洗脱剂各1个柱体积依次进行梯度洗脱,经薄层层析检测合并后进一步得到7个组分(Fr. 2−3−1~Fr. 2−3−7)。Fr. 2−3−4(9 g)经MCI−gel CHP20P柱层析(50 cm×6 cm),甲醇∶水(体积比为0∶1~1∶0)各1个柱体积依次洗脱后,得到9个组分(Fr. 2−3−4−1~Fr. 2−3−4−9),其中Fr. 2−3−4−6经硅胶柱(50 cm×3 cm,氯仿∶甲醇,20∶1~1∶10)和葡聚糖凝胶柱LH−20(50 cm×2 cm,甲醇∶水,体积比为0∶1~1∶0)层析后,得到化合物1(34.8 mg)和化合物2(10 mg)。
化合物1为白色不定形粉末,ESI+−MS质谱显示其准分子离子峰m/z477 [M+Na]+,HR−ESI+−MS质谱显示准分子离子峰m/z477.1369 [M+Na]+(calcd, 477.1367),结合13C NMR DEPT谱显示化合物1含有21个碳信号,其中包括1个伯碳(CH3)、3个仲碳(CH2)、12个叔碳(CH)和5个季碳(C),表明化合物1的分子量为454,分子式为C21H26O11,不饱和度为9。
化合物1的1H NMR谱显示出一组β−D−吡喃葡萄糖基质子信号(δH4.41(1H,d,J=7.8 Hz,H−1′),4.51(1H,dd,J=10.0,1.9 Hz,H−6′b),4.33(1H,dd,J=10.0,6.4 Hz,H−6′a),3.55(1H,m,H−5′),3.38(1H,dd,J=9.0,6.8 Hz,H−3′),3.32(1H,m,H−4′),3.22(1H,dd,J=8.5,8.2 Hz,H−2′)),一组芳香环ABX偶合质子信号(δH7.04(1H,d,J=1.9 Hz,H−2″),6.94(1H,dd,J=8.2,1.9 Hz,H−6″),6.79(1H,d,J=8.2 Hz,H−5″)),和一组反式双键质子信号(δ 7.56(1H,d,J=15.9 Hz,H−7″),6.28(1H,d,J=15.9 Hz,H−8″))(表1)。此外,还观察到2个连氧CH质子信号(δH4.24(1H,m,H−3),4.81(1H,m,H−5)),两组CH2质子信号(δH2.72(2H,m,H−2);
2.25(1H,br d,H−4b),1.66(1H,t,H−4a))和1个CH3质子信号(δH1.30(3H,d,J=6.4 Hz,H−6))的存在(表1)。
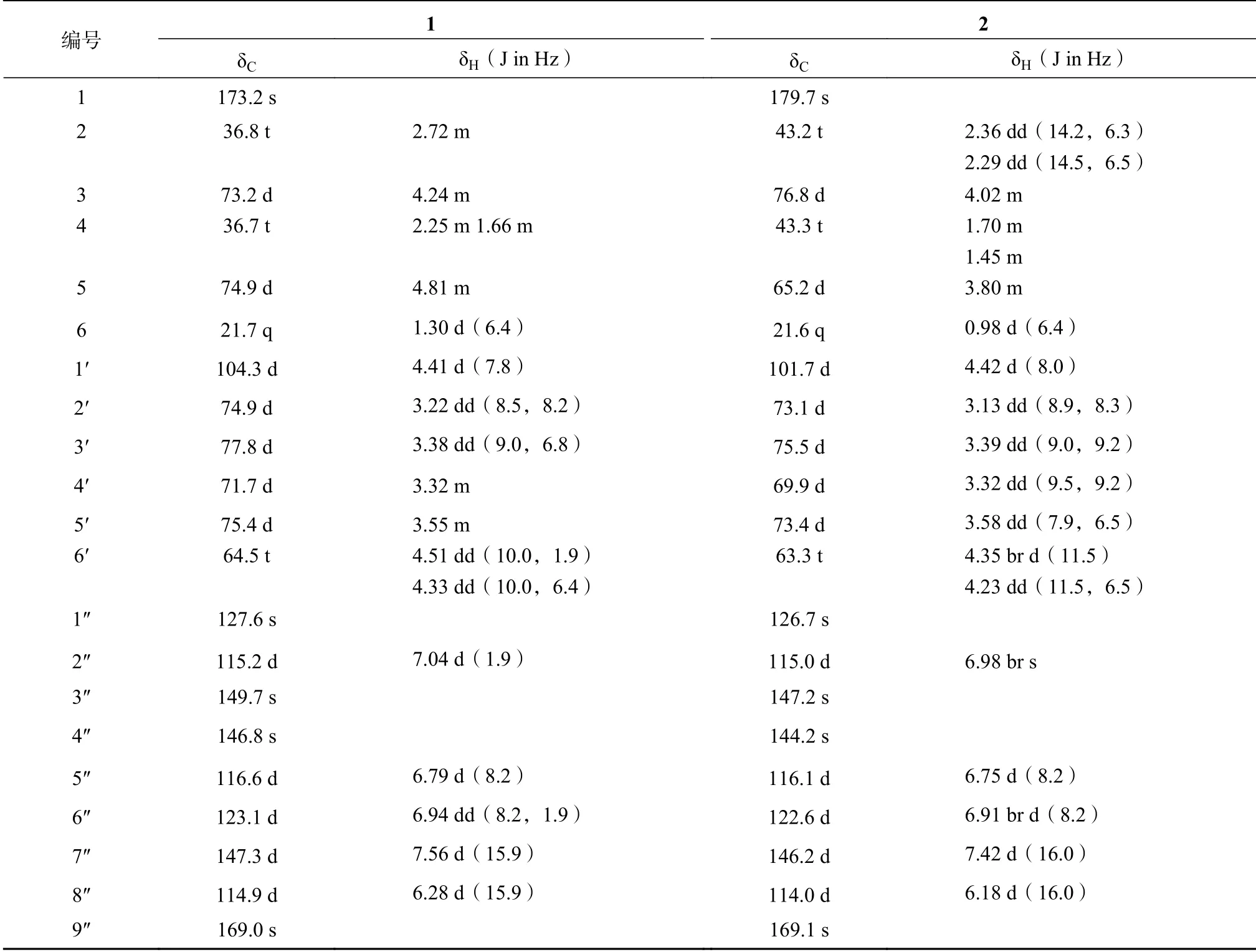
表1 化合物1和2的1H(400 MHz)和13C(125 MHz)核磁共振波谱数据(CD3OD)Table 1 1H(400 MHz)and 13C(125 MHz)NMR spectroscopic data for compounds 1 and 2(CD3OD)
13C NMR谱除显示出一组β−D−吡喃葡萄糖基碳信号和一组典型的反式咖啡酰基碳信号之外,还显示有1个羰基碳(δ 173.2)、2个连氧叔碳(δc 74.9,73.2)、2个仲碳(δc 36.8,36.7)和1个甲基碳信号(δc 21.7)(表1),推测化合物1中含有1个α−吡喃酮结构单元。通过1H−1H COSY和HSQC谱分析,对上述质子信号和碳信号进行了一一归属,并从1H−1H COSY和HMBC相关(图1)进一步确定化合物1的苷元为3−hydroxy−5−hexanolide。HMBC谱中显示的β−D−吡喃葡萄糖端基质子信号(δH4.41)与α−吡喃酮C−3位碳信号(δc 73.2),以及α−吡喃酮C−3位上质子信号(δH4.24)与葡萄糖端基碳信号(δc 104.3)之间的相关,表明β−D−吡喃葡萄糖连接在α−吡喃酮的C−3位上。β−D−吡喃葡萄糖的H−6′(δH4.51,4.33)与反式咖啡酰基中的C−9″羰基碳信号(δc 169.0)的HMBC相关,表明反式咖啡酰基连接在葡萄糖的C−6位上。
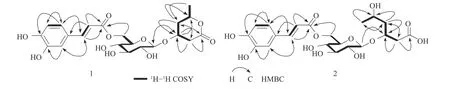
图1 化合物1和2的1H−1H COSY和HMBC相关Fig. 1 Key 1H−1H COSY and HMBC correlations of compounds 1 and 2
通过进一步比较1H和13C NMR谱数据(表1),发现化合物1和分离自紫萁科(Osmundaceae)紫萁(Osmunda japonica)[22]和樟叶越桔[14]的类花楸酸苷[(3R,5R)−3−(β−D−glucopyranosyloxy)−5−hexanolide,parasorboside],里白科(Gleicheniaceae)光里白(Diplopterygium laevissimum)的hymenoside X[23]和膜蕨科华东膜蕨(Hymenophyllum barbatum)的hymenoside U[24]相类似,不同之处在于化合物1比类花楸酸苷多了一组反式咖啡酰基的信号,而hymenoside X分子中反式对羟基肉桂酰基和hymenoside U中的3,4−二羟基苯乙酰基各自分别连接在葡萄糖的2位上。化合物1的旋光值([α]D25=−26.2(c = 0.015,MeOH))与类花楸酸苷([α]D20=−20.0(c=1.0,H2O))[22]、hymenoside X([α]D18.8=−42.1(c=0.11,MeOH))[23]和hymenoside U([α]D22=−29.0(c=2.8,MeOH))[24]进行比较,表明化合物1中C−3位和C−5位的构型也为3R和5R。因此,化合物1的化学结构确定为(3R,5R)−3−(6′−O−trans−caffeoyl−β−D−glucopyranosyloxy)−5−hexanolide(图2),命名为樟叶越桔苷K(dunalianoside K)。
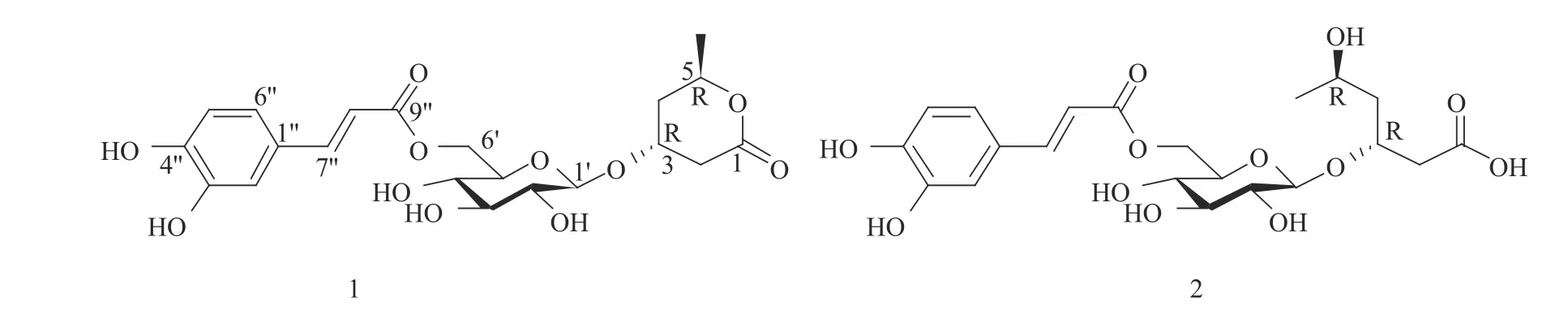
图2 樟叶越桔苷K(1)和樟叶越桔苷L(2)的化学结构Fig. 2 Chemical structures of dunalianoside K(1) and dunalianoside L(2)
化合物2为白色无定形粉末,ESI+−MS质谱显示其准分子离子峰m/z495 [M+Na]+,HR−ESI+−MS质谱显示其准分子离子峰m/z495.1469 [M+Na]+(calcd,495.1473),结合13C NMR DEPT谱显示化合物2含有21个碳信号,其中包括1个伯碳(CH3)、3个 仲 碳(CH2)、12个 叔 碳(CH)和5个季碳(C),表明化合物2的分子量为472,分子式为C21H28O12,不饱和度为8。
化合物2的1H NMR和13C NMR谱数据与化合物1的非常相似,同样表明了6−O−咖啡酰−β−D−葡萄吡喃糖基的存在,同时还观察到1个甲基(δH0.98(3H,d,J=6.4 Hz,H−6);
δc 21.6(d,C−6))、2个CH2(δH2.36(1H,dd,J=14.2,6.3 Hz,H−2a),2.29(1H,dd,J=14.5,6.5 Hz,H−2b)/δc 43.2(t,C−2);
δH1.70(1H,m,H−4a),1.45(1H,m,H−4b)/δc 43.3(t,C−4)]、2个连氧CH[δH4.02(1H,m,H−3)/δc 76.8(d,C−3);
δH3.80(1H,m,H−5)/δc 65.2(d,C−5))和1个羰基信号(δC179.7)的存在。与化合物1相比,化合物2仅是苷元部分的信号与化合物1不同,且化合物2比化合物1多18个质量数,并少1个不饱和度,推测化合物2的苷元为α−吡喃酮开环的链状结构。通过1H−1H COSY和HSQC谱分析,对化合物2的所有质子信号和碳信号进行了一一归属,并从1H−1H COSY和HMBC相关(图1)进一步确定化合物2的苷元为α−吡喃酮开环的链状结构。在HMBC谱中(图1),β−D−吡喃葡萄糖端基质子信号δH4.42(1H,d,J=8.0 Hz,H−1′)与苷元中的C−3位碳信号(δc 76.8)之间的相关,表明β−D−吡喃葡萄糖连接在苷元的C−3位上。β−D−吡喃葡萄糖6位上的质子信号δH4.35(1H,br d,J=11.5 Hz,H−6′b)和δH4.23(1H,dd,J=11.5,6.5 Hz,H−6′a)与反式咖啡酰基中的C−9″羰基碳信号(δc 169.1)的HMBC相关,表明反式咖啡酰基连接在葡萄糖的C−6位上。
通过进一步比较1H和13C NMR谱数据(表1),发现化合物2与分离自光里白的hexanoside A[23]和华东膜蕨的methyl−(3R,5R)−5−hydroxy−(β−D−glucopyranosyloxy)−hexanoate[24]的结构相似。通过对比化合物2([α]D25=−48.3(c=0.01,MeOH))与 上 述 二 者([α]D24=−27.8(c=1.15,MeOH);
[α]D19.1=−38.5(c=0.10,MeOH))的旋光值,表明化合物2的C−3位和C−5位的构型也为3R和5R。因此,确定化合物2的化学结构确定为(3R,5R)−3−(6′−O−trans−caffeoyl−β−D−glucopyranosyloxy)−5−hydroxy−hexanoic acid(图2),命名为樟叶越桔苷L(dunalianoside L)。
本研究进一步从樟叶越桔叶中分离鉴定了2个新的6−O−咖啡酰葡萄糖苷,即樟叶越桔苷K(1)和樟叶越桔苷L(2),2个化合物仅苷元结构不同,化合物2的苷元为化合物1中α−吡喃酮开环的链状结构。有文献报道认为(3S,5S)−5−hexanolide在 甲 醇 中 容 易 形 成methyl−(3S,5S)−hydroxy−hexanoate[25],但在本研究中化合物2是以游离羧酸的形式存在,因此化合物1和2为樟叶越桔叶中的天然产物。从化合物1和2的化学结构上来看,二者与樟叶越桔叶芽和叶中分离得到的咖啡酰熊果苷类化合物[14−15]均属6−O−咖啡酰葡萄糖苷衍生物,提示樟叶越桔叶芽和叶中含有丰富的葡萄糖:6−O−咖啡酰基转移酶基因家族成员[26],开展该基因家族成员的基因克隆与功能分析等相关研究,将有助于阐明6−O−咖啡酰葡萄糖苷衍生物的生物合成机制。此外,有文献报道发现类花楸酸苷和methyl−(3S,5S)−5−hydroxy−(β−D−glucopyranosyloxy)−hexanoate对黄蝴蝶幼虫具有显著的昆虫拒食活性[22],而结构相似的化合物1和2是否也具有类似的生物活性,值得开展进一步的相关研究。
猜你喜欢 反式甲醇葡萄糖 拆除“餐桌上的定时炸弹”食品界(2022年4期)2022-04-25硅胶吸附管采集甲醇汽车尾气排放中甲醇的方法研究汽车实用技术(2022年4期)2022-03-07医生手术后“豪饮”葡萄糖注射液 一般人能喝吗保健与生活(2021年4期)2021-02-22糖尿病患者能吃氨基葡萄糖吗家庭百事通·健康一点通(2020年11期)2020-11-30浅谈天然气制甲醇与煤制甲醇的区别E动时尚·科学工程技术(2019年11期)2019-09-10反式脂肪没你想的那么可怕现代家长(2019年2期)2019-03-18低温甲醇洗装置甲醇消耗高原因与应对措施进出口经理人(2017年7期)2017-09-20奶精不等于反式脂肪酸健康博览(2015年12期)2015-12-02超/亚临界水中还原糖分解特性哈尔滨理工大学学报(2014年3期)2015-01-04甲醇生产精馏操作技术探讨城市建设理论研究(2014年25期)2014-09-24








