快速无菌检查方法在细胞和基因治疗产品中的应用及监管概述
时间:2022-09-28 19:40:05 来源:柠檬阅读网 本文已影响 人 
王诗琳 于玲莉 成殷
摘 要 细胞和基因治疗产品是个体化产品,产量小、效期短,无菌检查需采用快速检查法。本文介绍细胞和基因治疗产品的快速无菌检查方法及其制造商在实际应用过程中可能会遇到的主要问题,供业界和监管部门参考。
关键词 细胞治疗 快速微生物检查 无菌
中图分类号:R951;
R927.1 文献标志码:C 文章编号:1006-1533(2022)11-0014-03
引用本文 王诗琳, 于玲莉, 成殷. 快速无菌检查方法在细胞和基因治疗产品中的应用及监管概述[J]. 上海医药, 2022, 43(11):
14-16;
35.
Application and regulation of rapid sterility test in cell and gene therapy products
WANG Shilin, YU Lingli, CHENG Yin
(Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China)
ABSTRACT Cell and gene therapy products are individualized products with low yield and short shelf life. Rapid test is needed for sterility test. This article introduces the rapid sterility test of cell and gene therapy products and the main problems that the manufacturers may encounter in the actual application process so as to provide reference for the industry and regulatory authorities.
KEY WORDS cell therapy;
rapid microbial examination;
sterility
細胞和基因治疗产品是个体化产品,产量小、效期短,无菌检查需采用快速检查法。本文介绍细胞和基因治疗产品的快速无菌检查方法及其制造商在实际应用过程中可能会遇到的主要问题,供业界和监管部门参考。
1 细胞和基因治疗产品
在我国,细胞治疗产品不包含输血用血液成分、未经体外处理的移植用造血干细胞、生殖相关细胞,以及由细胞组成的组织、器官类产品等[1]。
2 快速无菌检查方法
快速无菌检查方法包括三磷酸腺苷生物发光成像法、流式细胞术法、等温微量热法、实时定量核酸扩增法、基于呼吸作用的无菌检测方法、固相细胞计数法[2]、同源序列核酸扩增法[3]、羧基荧光素二醋酸酯和4, 6-二脒基-2-苯基吲哚双染色荧光计数法[4]等(表1)。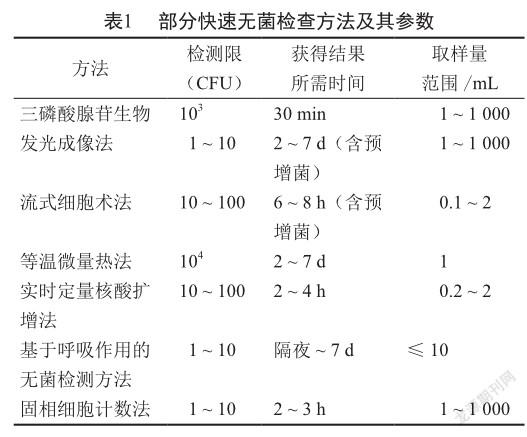
目前,对细胞和基因治疗产品的快速无菌检查主要采用商业化的仪器或设备进行,其中以基于呼吸作用的无菌检测方法最常用,所用技术主要包括:①基于二氧化碳底物显色的检测技术。通过仪器配套的专用培养瓶进行微生物培养,微生物增殖后产生的二氧化碳引起瓶内H+浓度变化,瓶底的显色硅胶感应器与H+结合而发生颜色变化,从而被仪器检测和记录。②基于荧光增强显示的检测技术。通过仪器配套的专用培养瓶进行微生物培养,微生物增殖后产生的二氧化碳引起瓶底荧光底物的光强度和波长变化,从而被仪器检测和记录。
3 国内外对细胞和基因治疗产品快速无菌检查法的监管要求
3.1 国内监管要求
2021年10月国家药典委员会公布的《细胞类制品微生物检查法草案拟公示稿》[5]中指出,采用快速微生物检查法进行细胞类制品放行检查,应充分考虑细胞类制品的生产工艺、无菌保障水平、微生物污染风险和使用者的获益风险比等因素,基于风险有条件地施行。
2022年1月,国家药品监督管理局公布了《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》[6],对细胞治疗产品从供者物料的运输、接收,产品的生产、检验,到成品的放行、储存和运输的全过程提出了质量控制的要求。
3.2 国外监管法规
美国药典42版-国家处方集37版通则<1071>《短效期产品放行的快速微生物检查:依据风险评估的方法》[2]中指出,快速微生物检查应基于风险评估施行,其可用于中间过程控制,作为获得无菌结果和对污染及早发现、及早控制的手段。
欧盟药品生产质量管理规范附录2《人用生物原料药和药品的生产》[7]中指出,对于短效期和终产品需要提前进行批认证的生物药品,应考虑采用其他等效的方法,包括快速微生物检查法。可在两个或多个阶段进行批认证和放行。
3.3 验证要求
在以快速无菌检查法替代现行中国药典的无菌检查方法前,制造商必须开展快速无菌检查法替代中国药典无菌检查方法的验证工作,定性验证参数包括专属性、检测限、耐用性、重现性等。制造商可参考中国药典2020年版通则9201[8]、美国药典40版-国家处方集35版通则<1223>[9]、欧洲药典9.2版通则5.1.6[10]、欧洲药典10.3版通则2.6.27[11]和美国注射剂协会第33号技术报告[12]等中的相关要求开展验证(表2)。须确认快速无菌检查法的应用效果优于或至少等同于传统无菌检查法。A636CD05-F3BB-4D7F-830D-328A56D78017
4 制造商在应用快速无菌检查方法过程中遇到的主要问题
细胞和基因治疗产品的制造商在应用快速无菌检查方法的过程中会遇到各种问题,概括起来主要包括以下几项。
1)样品成本
中国药典2020年版通则9201[8]中指出,替代方法学验证参数应包括专属性、检测限、耐用性和重现性。验证试验需要使用大量的样品,而细胞和基因治疗产品的产量极小且成本极高,传统的无菌检查法的取样方案并不适用。中国药典要求尽量使用产品进行无菌检查,但因其单次产量极小,现阶段也接受具有代表性的供试品,如在生产过程中不同的点取样和最终制剂取样的检查方案[13]。
2)菌株浓度
中国药典2020年版通则9201[8]中指出,检测限试验中接种的试验菌為每单位不超过5 CFU,以达到接种后采用中国药典方法在50%的样品中即可检出该试验菌的效果。因此,检测限试验中通常需要设置极低的菌株浓度,如每单位不超过2 CFU,但实际上很难配制恰好符合要求的菌株浓度。此外,当菌株浓度极低时,使用胰酪大豆胨琼脂平皿培养的需氧菌计数结果可能不准确。为了覆盖试验所需菌株浓度,通常需要进行多梯度稀释,而这会增加样品的损耗。目前少有商业化的适用于检测限验证的各种固定浓度的菌株,通常需要制造商自己配制。
3)取样量
中国药典2020年版通则9201[8]中并未提及快速无菌检查方法验证的样品接种量,而其实际接种量有别于传统的无菌检查法,制造商一般会参照国外药典的要求设置接种量。验证时每份培养基的产品接种量应与产品放行时的快速无菌检查法一致。对于单个容器且总体积在1 ~ 1 000 mL的单一批次细胞治疗产品,接入每份培养基的产品量有一定的要求(表3)[11]。
4)放行策略
制造商必须对快速无菌检查法和传统的无菌检查法进行比较和评估,必要时同步进行相互的验证[14]。在两法平行施行期间,应以现行中国药典规定的无菌检查法检查结果为产品无菌检查的最终判定依据。应关注两法检查结果不一致的供试品,对检查过程进行充分的调查。
5)方法的再确认或再验证
为保证快速无菌检查方法在供试品无菌检查过程中的适用性,应关注生产和检查过程中可能对方法适用性有影响的因素的变更或变化,如生产工艺变更、无菌检查方法修订、供试品变更等。应评估这些变更或变化是否会影响快速无菌检查方法的灵敏度、重现性等,并依据评估结果对方法进行全面或部分的再确认或再验证[15]。
5 结语
细胞和基因治疗产品产量小、效期短的特点决定了对该类产品施行快速无菌检查法是必要的。不过,目前国内制造商进行快速无菌检查法方法学验证的难度不小,须解决技术上的难题,积累足够的验证试验数据,为缩短快速无菌检查法与现行中国药典无菌检查法的平行施行期打下基础,并与监管部门一起共同促进细胞和基因治疗产品相关法规体系的升级,保障人民的生命健康和用药安全。
参考文献
[1] 国家食品药品监督管理总局. 细胞治疗产品研究与评价技术指导原则(试行)[EB/OL]. (2017-12-22) [2022-04-02]. https://www.nmpa.gov.cn/directory/web/nmpa/images/MjAx N8TqtdoyMTa6xc2ouOa4vbz+LmRvY3g=.docx.
[2] 刘洪祥, 李娅男, 译. 《美国药典》(42/NF37)<1071> 无菌短货架期产品放行的快速微生物检查法:依据风险评估的方法[J]. 中国药品标准, 2020, 21(3):
195-201.
[3] Rapid identification of microorganisms based on molecular biological method [M]//Pharmaceuticals and Medical Devices Agency of Japan. The Japanese Pharmacopoeia, sixteenth edition, English version. Tokyo:
Ministry of Health, Labour and Welfare, 2011:
2220-2221.
[4] Rapid counting of microbes using fluorescent staining [M]// Pharmaceuticals and Medical Devices Agency of Japan. The Japanese Pharmacopoeia, seventeenth edition, English version. Tokyo:
Ministry of Health, Labour and Welfare, 2015:
2501-2503.
[5] 国家药典委员会. 细胞类制品微生物检查法草案拟公示稿[EB/OL]. (2021-10-26) [2022-04-02]. https://www.chp.org. cn/attachment.jspx?cid=16551&i=0&t=1652451163326&k=1 697d4ed9269f654d3bc34e8cc957460.
[6] 国家药品监督管理局. 药品生产质量管理规范-细胞治疗产品附录(征求意见稿)[EB/OL]. (2022-01-06) [2022-04-02]. https://www.nmpa.gov.cn/directory/web/nmpa/ images/1641459325244001478.docx.A636CD05-F3BB-4D7F-830D-328A56D78017
[7] EudraLex. The rules governing medicinal products in the European Union. Volume 4. EU guidelines for good manufacturing practice for medicinal products for human and veterinary use. Annex 2. Manufacture of biological active substances and medicinal products for human use [EB/OL].(2018-06-26) [2022-04-02]. https://ec.europa.eu/health/ system/files/2019-02/2018_annex2_en_0.pdf.
[8] 9201 药品微生物检验替代方法验证指导原则[M]//国家药典委员会. 中华人民共和国药典2020年版四部. 北京:中国医药科技出版社, 2020:
494.
[9] <1223> Validation of alternative microbiological methods[M]//The United States Pharmacopeial Convention. The United States Pharmacopeia, fortyth edition/National Formulary, thirtyfifth edition. Washington D.C.:
The United States Pharmacopeial Convention, 2017:
1756-1770.
[10] 5.1.6 Alternative methods for control of examination of microbiological quality [M]//European Pharmacopoeia Commission. European Pharmacopoeia 9.2. Strasbourg:
The European Directorate for the Quality of Medicines & HealthCare, 2017:
4344-4347.
[11] 2.6.27 Microbiological examination of cell-based preparations[M]//European Pharmacopoeia Commission. European Pharmacopoeia 10.3. Strasbourg:
The European Directorate for the Quality of Medicines & HealthCare, 2021:
4773-4776.
[12] Parenteral Drug Association. Technical report No. 33(revised 2013). Evaluation, validation and implementation of alternative and rapid microbiological methods[EB/OL]. [2022-04-02]. https://max.book118.com/ html/2019/1009/5220213031002134.shtm.
[13] 中國食品药品检定研究院. CAR-T细胞质量控制检测研究及非临床研究考虑要点[EB/OL]. (2018-06-05) [2022-04-02]. https://news-files.yaozh.com/systemFile_25/96f5efeb3b1 9339d8b7467bc8e597748.pdf.
[14] 国家药品监督管理局药品审评中心. 细胞制品研究与评价技术指导原则(征求意见稿)[EB/OL]. (2016-12-16)[2022-04-02]. https://www.cde.org.cn/main/att/download/ a764b5ce11dda7eb0ffce4527131561a.
[15] 国家药品监督管理局药品审评中心. 生物制品上市后变更研究技术指导原则(征求意见稿)[EB/OL]. (2017-09-07) [2022-04-02]. https://www.cde.org.cn/main/att/download/ e70386f57599689e687fbddc61c63a15.A636CD05-F3BB-4D7F-830D-328A56D78017
猜你喜欢 无菌 在食品安全检验中护理学无菌操作的应用研究食品界(2021年12期)2021-12-20浅析无菌管道施工要点科学与财富(2021年36期)2021-05-10简述微生物实验无菌操作的基本要求食品安全导刊·中旬刊(2021年2期)2021-05-06一种可以产生无菌风的操作系统现代商贸工业(2020年1期)2020-02-06隔离器在制药业的应用中国科技纵横(2019年14期)2019-09-18两种持物钳筒在不同级别洁净手术室内的临床应用及效果评价中国医学创新(2019年12期)2019-08-19无菌操作技术在无菌制剂生产中的应用科学与财富(2017年8期)2017-04-11无菌管道用快装制药级旋转密封装置科技创新与应用(2017年6期)2017-03-239S管理法在手术室无菌间无菌物品管理中的应用中国医学人文杂志(2015年10期)2015-10-21婴儿用水需要灭菌吗?百科知识(2015年17期)2015-09-10








